8. С тяжелыми
боями продвигаются...
Очень плохо поддаются химиотерапии вирусные инфекции... Сейчас особенное
значение имеет борьба с ВИЧ-инфекцией, приводящей к СПИДу, и здесь уместно
рассказать об одной из самых неприятных и трудно преодолимых трудностей
в этой борьбе.
Размножение ретровируса ВИЧ с необходимостью включает работу двух ферментов:
обратной транскриптазы и специфической протеазы. Первый из этих ферментов
синтезирует ДНК по матрице вирусной РНК, а второй нарезает исходные вирусные
белки-предшественники на фрагменты - зрелые вирусные белки.
Получено множество высокоэффективных ингибиторов обоих ферментов, которые
поначалу прекрасно тормозят размножение ВИЧ в организме. Увы, терапевтическое
действие подобных препаратов быстро сходит на нет, поскольку чувствительные
к ним штаммы вытесняются устойчивыми мутантами. Аномально высокая изменчивость
ВИЧ и других ретровирусов обусловлена тем, что работа обратной транскриптазы
проходит со значительно большим числом ошибок, чем при обычной редупликации
ДНК.
Устойчивые вирусы-мутанты, вообще говоря, менее "жизнеспособны"
и вирулентны, чем дикий штамм, но в присутствии ингибиторов они одерживают
над ним победу в борьбе за общую экологическую нишу - клетки нашей иммунной
системы. Надежды на преодоление этой напасти основаны на применении таких
ингибиторов и их сочетаний, устойчивость к которым возникает лишь при одновременных
мутациях в нескольких точках, что статистически маловерятно.
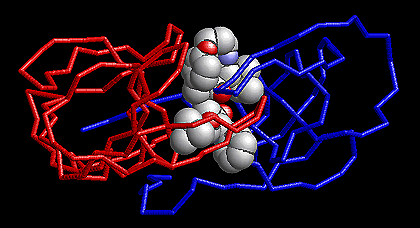
Протеаза вируса иммунодефицита
человека состоит из двух одинаковых субъединиц. Ее ингибиторы, занимающие
внутреннюю полость белкового димера, не дают ферменту нарезать исходный
вирусный белок на функционально активные фрагменты, блокируя, тем самым,
размножение вируса. Увы, частые мутации быстро приводят к появлению штаммов
вируса, у которых протеаза лишена сродства к используемым ингибиторам.
|
Не менее остра проблема избирательности при лечении злокачественных
новообразований. Пока что в основе химиотерапии рака лежат цитостатики,
то есть препараты, тормозящие размножение клеток. Их применение основано
на наиболее очевидном отличии раковых клеток от нормальных - склонности
к бесконтрольному делению. Как правило, цитостатики химически повреждают
ДНК, служат антиметаболитами, извращающими ее биосинтез, или ингибируют
какой-либо из ферментов, участвующих в репликации. Некоторые имеют мишенью
некоторые из них имеют мишенью элементы цитоскелета, входящие в митотический
аппарат.
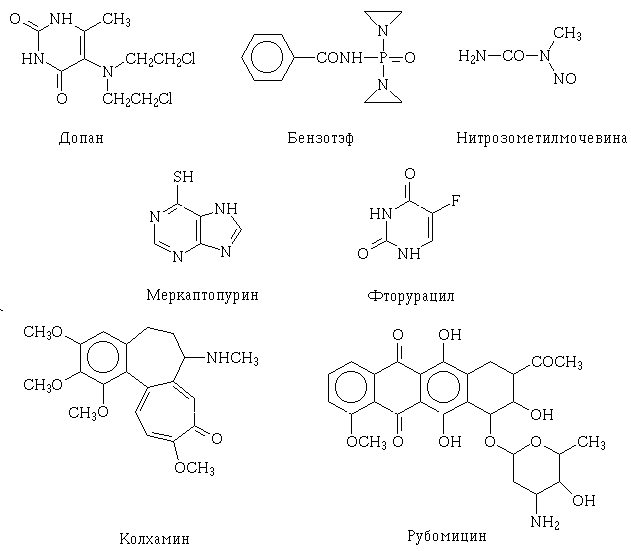
Противораковые препараты сильно
различаются механизмами действия. В верхней строке - химические модификаторы
белков и нуклеиновых кислот. В средней - антиметаболиты пуриновых оснований.
Колхамин нарушает работу митотического аппарата делящихся клеток, а рубомицин
- биосинтез нуклеиновых кислот. |
Главная беда здесь в том, что в организме больного достаточно часто
делятся не только раковые клетки, но и многие другие, например, эпителиальные
и стволовые ( а у доброй половины пораженных раком, между прочим, непрерывно
образуются сперматозоиды). Все эти вполне нормальные клетки тоже поражаются
цитостатиками, и потому химиотерапия рака становится прогулкой по узкой
тропке, разделяющей две пропасти - смерть от болезни и смерть от лечения.
Пока мы еще не научились надежно снабжать молекулы цитостатиков адресующими
участками, позволяющими им находить и поражать только раковые клетки. Однако
исследования в этом направлении интенсивно ведутся во всем мире А параллельно
разрабатываются способы адресации не отдельных молекул, а их пакетов. Один
из вариантов -- включение тех же цитостатиков в липосомы, на внешней поверхности
которых расположены молекулы, дополнительные к специфическим рецепторам
раковых клеток. Такие липосомы призваны служить своего рода микрошприцами,
которые при слиянии с клеткой вспрыскивают свое содержимое в цитоплазму.
Современные методы избирательного воздействия на раковые клетки поражают
своей изощренностью. Например, цитостатик превращают в неактивное гидролизуемое
производное, стараясь одновременно облегчить его перенос через плазматическую
мембрану. Такое производное будет безопасно для клеток, если только в них
нет фермента, способного расщепить его с образованием активного начала.
А раковые клетки снабжают соответствующими ферментами-гидролазами, либо
пришивая их к антителам против специфических для опухолей поверхностных
антигенов, либо внедряя в эти клетки ген фермента с помощью специально
сконструированного вируса.
Вы спросите, почему же все эти хитроумные подходы (а я помянул здесь
только малую их часть) до сих не позволяют надежно излечивать людей? Причин
тому много, но основная - неполнота наших знаний о молекулярной природе
раковых заболеваний. Поэтому главная проблема здесь не в разработке лекарств,
а в поиске глубоко запрятанных мишеней.
9. Злейший
враг - кислород
Мы так много говорим здесь об избирательности, что вроде не остается
никакой надежды на панацею -- лекарство, пусть даже не универсальное, но
лечащее сразу от многих болезней и отравлений. Между там, такие лекарства,
как ни странно, есть, и называются они антиоксидантами.
С тех пор, как растения насытили кислородом первичную атмосферу Земли,
все организмы научились защищаться от этого главного окислителя и, в сущности,
врага всего живого. Сам по себе кислород довольно инертное вещество, и
спонтанно окисляет органические вещества очень медленно. Однако первичные
продукты окисления - гидроперекиси ROOH, - далее распадаются, рождая различные
высокоактивные частицы. Одни из них образуются при разрыве связей в окисляемых
молекулах, а другие - Н2О2, НО2·,
ОН·, [O] - представляют собой продукты частичного восстановления
кислорода. С участием этих частиц окисление приобретает характер цепной
самоподдерживающейся реакции.
У подавляющего большинства организмов (кроме облигатных анаэробов, например
кишечных глистов) в клетках существуют мощные ферменты (каталаза, супероксиддисмутаза),
которые уничтожают активные формы кислорода. Любой прорыв этой оборонительной
цепи приводит к повреждению клеток и, в конечном итоге, отражается на состоянии
организма в целом.
Наиболее опасно цепное окисление (его обычно называют перекисным) ненасыщенных
жирнокислотных остатков в мембранных фосфолипидах. Перекисное окисление
обычно развивается при недостаточном снабжении клеток кислородом. При этом
в них накапливаются восстановленные формы многих метаболитов, способные
самостоятельно окисляться кислородом в гидроперекиси. Поэтому окислительные
повреждения мембран одно из самых опасных последствий ишемических заболеваний
и многих других недугов, связанных с ухудшением транспорта кислорода к
тканям.
Перекисное окисление мембранных липидов -- спутник рака, лучевых поражений,
старения, некоторых отравлений; и во всех случаях применяют универсальный
метод борьбы с этим злом. Суть этого метода довольно проста... Даже незначительное
снижение стационарной концентрации активных частиц приводит к тому, что
окисление перестает быть цепным. Это общее свойство всех цепных реакций,
и останавливают их почти всегда одинаково, подменяя активные частицы менее
реакционноспособными с помощью ловушек радикалов. Ловушками обычно служат
соединения, при одноэлектронном окислении которых активными радикалами
образуются тоже радикалы, но более инертным. В медицине в качестве таких
ловушек (их принято называть антиоксидантами) используют и синтетические
препараты (например, дибунол), и вещества природного происхождения (токоферол,
аскорбиновая кислота).
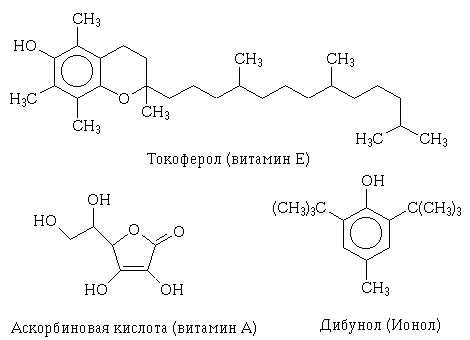
В отличие от природных антиоксидантов
- витаминов С и Е - дибунол является синтетическим препаратом. Антиоксиданты
защищают липиды, белки и нуклеиновые кислоты от от окислительных повреждений,
являющихся спутниками и причиной многих заболеваний. |
Орудия разрушения, иной раз, удается использовать и в благих целях.
Например, давно известно, что железопорфирины в водных растворах при освещении
генерируют активные формы кислорода. Теперь этот эффект начали применять
для уничтожения раковых клеток. Избирательность действия здесь достигается
двояко: во-первых, порфирины стараются ввести преимущественно в опухоли,
а, во-вторых, только опухоли освещают актиничным светом (до внутренних
опухолей добираются световодами).
10. Лекарства
в виртуальном мире
Лекарственная терапия развивается так быстро, что прогнозировать ее
будущее - занятие не из благодарных. Тем не менее, некоторые новые направления
очевидны. В частности, похоже что "белковые" лекарства, действие
которых направлено на ферменты и рецепторы, будут потеснены со временем
"нуклеиновыми", способными регулировать количество ферментов
и других белков, контролируя транскрипцию и трансляцию на уровне отдельных
генов. В основе подобных препаратов лежит так называемая аntisense technology
(русского эквивалента пока не придумали), иными словами точное адресование
с помощью сравнительно коротких синтетических олигонуклеотидов, комплементарных
определенным смысловым участкам нуклеиновых кислот. Все чаще попадаются
на глаза работы, в которых антисмысловые олигонуклеотиды используют
- для инактивации отдельных блоков ДНК или РНК путем укрытия их в двуспиральных
или триспиральных комплексах,
- для создания специфичных рибозимов (так называют каталитически активные
РНК, участвующие в сплайсинге) или же
- для адресации тех или иных реагентов, способные локально модифицировать
или разрезать нуклеиновую кислоту.
Чтобы исключить расщепление антисмысловых олигонуклеотидов внутриклеточными
нуклеазами фосфатные группы в них заменяют на тиофосфатные, а иногда также
модифицируют 3'и/или 5'-концевые остатки.
Что же касается "белковых" лекарств, то здесь успехи в значительной
мере будут обусловлены интенсивным применением вычислительных методов.
Тому есть, по меньшей мере, четыре предпосылки:
- В литературе есть описания синтеза сотен тысяч органических соединений,
и заметная их доля доступна в любой момент. Более, чем вероятно, что в
этой гигантской куче находятся вещества, которые обладают, пусть в небольшой
мере, нужной биологической активностью. Эти вещества могут послужить если
не действующим началом будущего лекарства, то хотя бы его прототипом;
- Для десятков тысяч органических соединений известны, пусть не все,
биологические активности, и вполне очевидно, что наличие и величина каждой
из этих активностей определенным образом коррелирует со структурой молекулы;
- Для сотен белков известна с атомным разрешением их трехмерная структура,
локализация участков связывания естественных лигандов и/или ингибиторов,
а также природа и расположение каталитически активных групп.
- Расчетные методы позволяют моделировать поведение белков в растворе,
белок-белковые и лиганд-белковые взаимодействия, а также находить энергетически
выгодные конформации молекул и цену их искажения.
Используя эти предпосылки, при создании новых лекарств удается не только
значительно сократить объем химических и биохимических экспериментов, заменяя
их вычислительными, но и проводить такие вычислительные эксперименты, для
которых практически невозможно придумать лабораторные эквиваленты.
Начнем с самого простого - нахождения формальной корреляции между структурой
и активностью. Строго говоря, установить корреляцию - значит выявить взаимозависимость
явлений, безотносительно к причине ее существования (об этой мелочи часто
забывают). Типичный случай - построение эмпирических уравнения, например,
аппроксимация экспериментальных точек полиномом. Такой полином может достоверно
предсказывать положение новых точек внутри исследованного интервала, но
он не имеет отношения к физической природе явления и опасен для экстраполяции.
Мы можем по определенным правилам представить любую химическую структуру
в виде списка входящих в нее стандартных конструкционных блоков и попытаться
установить корреляцию между содержанием этих списков и наличием некоей
биологической активности у соответствующих молекул. Подвергая этой процедуре
достаточно представительные выборки молекул, мы вправе допустить, что корреляция
существовать должна (строение определяет свойства!), и неудача может быть
обусловлена только несовершенством языка описания структур.
Не так трудно выделить в молекулах общие функционально значимые блоки,
если речь идет о родственных соединениях с одинаковой активностью. Но вовсе
не очевидно, можно ли найти единый набор таких блоков для сравнения разнотипных
вещества с различными активностями. Опыт, однако, показывает, что это возможно.
Подтверждением тому служит созданная в нашей стране компьютерная программа
PASS, разработанная В.Поройковым и Д.Филимоновым. В ней используется язык
описания структур, который еще в 1972 году предложил советский ученый В.Авидон.
PASS успешно генерирует спектр биологических активностей органических соединений,
и ее предсказательная сила возрастает по мере расширения набора соединений,
использованного для построения корреляций (так называемой обучающей выборки).
Разумеется, этот метод не позволяет ни обнаружить, ни сконструировать соединение
с активностью, которой нет в обучающей выборке, однако в некоторых случаях
он очень полезен.
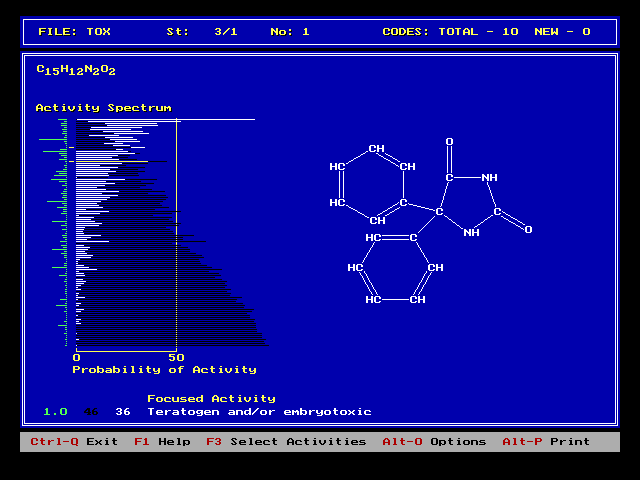
Компьютерную программу PASS,
о которой рассказано в статье, использовали для предсказания биологической
активности одного из противоэпилептических препаратов . Длина горизонтальных
белых линий отражает прогнозируемую вероятность того или иного действия
на организм (их рассматривается около сотни). Наболее вероятна, как и следовало
ожидать, противоэпилептическая активность, но это вещество возможно является
также канцерогеном и тератогеном. |
Например, выявление и изучение побочного действия новых лекарственных
препаратов поглощает массу времени, денег и сил, прежде всего, потому,
что таких эффектов может быть сколь угодно много. Проверить все возможности
просто нереально, а, выделяя те, что кажутся наиболее вероятными или опасными,
легко упустить из виду главного врага. Программы типа PASS уменьшают шанс
такого "прокола", потому что неожиданный побочный эффект может
обнаружить себя в предсказанном спектре активностей препарата.
Сходная ситуация возникает и при массовой проверке органических соединений
с целью выловить потенциальные лекарственные препараты (англ. - screening)
Хотелось бы выявить все активности, но прямым экспериментом сделать это
явно невозможно... И здесь предсказание спектра активностей позволяет экономить
усилия и кардинально улучшить продуктивность. Например, появляется возможность
предсказывать у проверяемых структур сочетание активностей и отыскивать
соединения с необычными терапевтическими возможностями (помните вековую
мечту шутников о послабляющем снотворном?).
Возможность предсказывать разные активности, используя общий язык описания
структур, имеет глубокий физический смысл. Дело в том, что низкомолекулярные
биологически активные соединения, используемые для нахождения корреляций,
взаимодействуют со своими рецепторами сходным образом, с помощью одних
и тех же структурных элементов. Это, если вдуматься, неудивительно, ибо
почти все рецепторы имеют белковую природу, и взаимодействие с ними описывается
стандартным набором: водородное связывание, электростатика (ион-ион, ион--диполь,
диполь--диполь) и контакты гидрофобных остатков.
В конце прошлого века один русский фотограф придумал, как создать портрет
среднего человека. Для этого он печатал на одном позитиве изображения от
большого числа совмещенных негативов. Что, если совместить в пространстве
структуры соединений с одинаковой активностью, исходя из предположения,
что все они связываются одним и тем же рецептором (такие соединения называют
лигандами данного рецептора). Проще всего это сделать для структур, в основе
которых лежит один и тот ведущий жесткий каркас (обычно полициклические
остатки).
Оказывается, такая операция очень помогает выявить общие закономерности:
вот в этом месте "любит" находиться донорная группа, а вот тут
- акцепторная; здесь - катион, а там - объемистый углеводородный радикал.
В каком-то направлении молекулы могут безнаказанно давать отростки, а в
другом - никогда, словно они упираются в непреодолимый барьер. Вероятно,
вы уже поняли, что анализ этих закономерностей позволяет составить представление
о том, как устроен рецептор. Помните, мы уже встречались раньше с такого
рода анализом устройства холинорецептора?
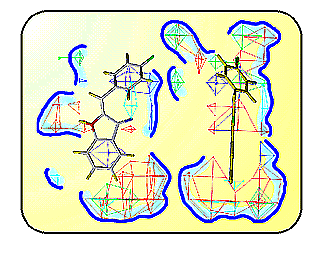
Сравнительный анализ структуры
субстратов и ингибиторов позволяет составить представление о пространственном
распределении различных свойств поверхности активного центра фермента.
Здесь показаны две проекции условного портрета моноаминооксигеназы со связанным
в нем ингибитором. Синий абрис и цветные полиэдры - оописывают контур участка
связывания и расположение на нем электрических зарядов, гидрофобных участков,
доноров и акцепторов протона. Такого рода модели часто с успехом используют
при конструировании новых ингибиторов, если неизвестно истинное строение
активного центра. |
Теперь, располагая "словесным портретом" рецептора, можно
заняться подбором для него ранее неизвестных лигандов. Для этого нужно
всего лишь брать одну за другой сотни тысяч известных органических молекул
и примерять их к нашему "портрету", стараясь, чтобы плюс оказался
против минуса, донор против акцептора и так далее. Не получилось, берем
следующую... Мощь современных компьютеров и продуманность алгоритмов позволяют
осуществить эту чудовищную по объему работу во вполне разумные сроки и
отобрать относительно небольшое число соединений, заслуживающих прямой
экспериментальной проверки на активность.
Кстати говоря, совсем не обязательно составлять портрет рецептора, используя
уже известные лекарства-ингибиторы. Их может быть известно очень мало,
а может вообще не быть. Представим себе: нужно сконструировать ингибитор
вирусной протеазы, про которую известно только то, что она способна разрезать
незрелые вирусные белки в 8-10-ти строго определенных точках. Мы вправе
предположить, что аминокислотные остатки вокруг гидролизуемыех связей определяют
специфичность этой протеазы и занимают сходное положение на общем для них
участке связывания. Иными словами, в этом случае портрет рецептора можно
создать, совмещая не ингибиторы, а естественные субстраты. Заметим, что
при последующем подборе лигандов по этому портрету в улове могут оказаться
вовсе не пептиды, а совершенно неожиданные соединения. Вспомним, что морфин
и другие опиатные алкалоиды отлично связываются рецепторами, предназначенными
Природой вовсе не для них, а для пептидов семейства эндорфинов.
В большинстве случаев "словесными портретами" рецепторов пользуются,
так сказать, по бедности, когда неизвестна их реальная структура. Но уже
сегодня круг белков с известной пространственной структурой достаточно
велик, и он расширяется с каждым годом. Более того, разработано много вычислительных
методов, которые позволяют предсказать эту структуру, исходя из аминокислотной
последовательности данного белка, и надежность таких методов, хотя и медленно,
но, все же, возрастает. Рентгеноструктурному анализу удается подвергнуть
кристаллы не только самих белков, но и их комплексов с лигандами: субстратами
или ингибиторами. А это позволяет однозначно локализовать в молекуле белка
участки связывания этих лигандов, то есть именно то, что мы собственно
и называем рецептором.
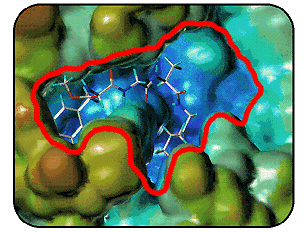
Так на экране компьютера выглядит
поверхность одного из протеолитических ферментов, воссозданная по данным
рентгеноструктурного анализа. Молекула ингибитора, располагаясь на участке
связывания субстратов, препятствует их взаимодействию с ферментом. Детальное
изучение участков связывания позволяет использовать вычислительные методы
для розыска или конструирования таких ингибиторов. |
Точное знание топографии рецептора позволяет применять весьма изощренные
методы конструирования лигандов. Вот один из них, который предполагает
существование алгоритма для оценки энергии взаимодействия лиганд-рецептор,
и некоего мешка с насыпанными туда фрагментами органических молекул. Нам
разрешены следующие, случайным образом чередующиеся операции:
- Случайный выбор фрагмента из мешка и помещение его в случайное незанятое
место на поверхности рецептора,
- Смещение фрагмента на поверхности в случайном направлении на случайное
расстояние,
- Случайные повороты фрагментов вокруг случайных осей на случайные углы,
- Случайные замены отдельных атомов и групп во фрагментах на другие согласно
оговоренным правилам,
- Присоединение случайно взятых из мешка фрагментов к уже размещенным
на рецепторе,
- Соединение воедино уже размещенных фрагментов мостиками из случайно
выбранных фрагментов (если это возможно из пространственных и чисто химических
соображений).
Все указанные операции сопровождаются оценкой энергии взаимодействия
и минимизацией конформационной энергии растущих молекул. Это позволяет
одобрять рост "хороших" лигандов и выбраковывать по ходу дела
"плохие". Система штрафов и поощрений дает возможность управлять
этой эволюцией, стимулируя, допустим, образование водородных связей, и
препятствуя появлению большого числа асимметрических центров, которые в
будущем затруднят синтез реального вещества.
Это потрясающе увлекательное занятие - следить за тем, как на ваших
глазах путем проб и ошибок из ничего возникает нужная молекула совершенно
непредсказуемого вида. Однако наивно полагать, будто успех здесь возможен
без вмешательства человека. По многим причинам совершенствование лиганда
происходит итерациями, включающими компьютерные расчеты, синтез промежуточных
структур и их биологические испытания.
 |
Компьютерная
программа DockSearch, созданная А.С. Ивановым и В.С. Скворцовым в Институте
биомедицинской химии РАМН, позволяет среди десятков тысяч органических
молекул выбирать те, которые удачно "вписываются" в участок связывания
субстратов на поверхности фермента. Если наложить друг на друга изображения
всех отобранных молекул, получается нечто вроде гипсового слепка участка
связывания. Эффективно ингибировать фермент будут, однако, только те соединения,
чьи молекулы не только по форме комплементарны участку связывания, но и
хорошо удерживаются на нем благодаря водородному связыванию или другим
видам межмолекулярных взаимодействий.
|
Главная особенность этого, да и всех других компьютерных методов проектирования
лекарственных препаратов, состоит в том, что они эффективны только в том
случае, если реализуются тесно взаимодействующими и "говорящими на
одном языке" биологами, химиками и специалистами по алгоритмам. Если
этого нет, техника бессильна...
11. Просто
лишь неизвестное
Упаси Бог, если у вас возникло впечатление, будто сотворение лекарства
заканчивается с нахождением эффективного антиметаболита или ферментного
ингибитора. По раскладу сил и времени это даже не начало. И все потому,
что лекарство борется с болезнью на молекулярном уровне, но не в пробирке,
а в теле больного. Разработчики лекарств прослеживают траекторию препарата
в организме с тщательностью и подозрительностью родителей, нанимающих грабителя,
насильника и убийцу, дабы изгнать террориста из богато обставленной спальни
любимой дочки.
Начнем с простейшего: как ввести лекарство в организм. Далеко не все
стоит глотать... Например белковые и пептидные лекарственные вещества полностью
или почти полностью расщепятся пищеварительными протеазами. Очень противна
во рту касторка или горький, как хинин, левомицетин (хлорамфеникол). Поэтому
касторку заключают в перевариваемые желатиновые капсулы, а таблетки левомицетина
покрывают глазурью. Некоторые лекарства распадаются в кислой среде, и в
этом случае защитные оболочки рассчитаны на то, чтобы пройти целенькими
через желудок и развалиться в кишках. Множество лекарственных веществ плохо
растворяются в воде - их нужно размалывать в пыль на хитроумных мельницах
и принимать меры против слипания этой пыли в комочки.
Кстати, сейчас довольно часто пользуются очень изящным методом диспергирования
водонерастворимых соединений: их молекулы при этом оказываются включенными
поодиночке во внутреннюю полость молекулярных бубликов из циклоолигосахарида,
т.н. циклодекстрина. Полость в таком бублике гидрофобна, а его внешняя
поверхность гидрофильна, так что циклодекстрин образует водорастворимые
комплексы именно с гидрофобными молекулами. Подобные комплексы называют
соединениями включения или клатратами. В водных растворах клатраты постепенно
диссоциируют, высвобождая гостя, спрятанного внутри хозяина. Дополнительная
выгода состоит в том, что в клатратах молекулы-гости (например, провитамина
A - каротина) защищены от окисления на воздухе.
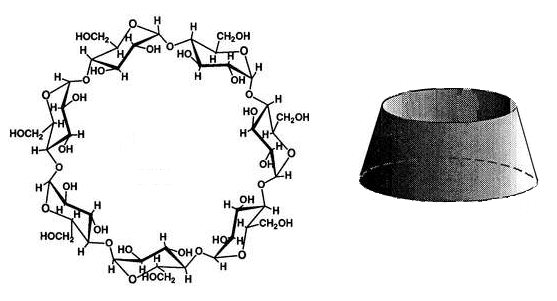
Циклогептаамилоза, обычно называемая
бета-циклодекстрином, вполне доступное вещество, получаемое в промышленных
масштабах путем микробиологической трансформации крахмала. Ее молекула
представляет собой пустотелый усеченный конус, в полости которого могут
разместиться молекулы многих лекарств. Растворимые в воде комплексы циклодекстрина
с гидрофобными соединениями диссоциируют, высвобождая "начинку"
в виде отдельных молекул. |
Есть немало тонкостей и во введении лекарств с помощью инъекций. Самые
простейшие уловки: водорастворимые препараты вкалывают в виде изотонических
растворов, содержащих местный анестетик, а жирорастворимые - часто вводят
подкожно в виде масляного раствора, из капель которого лекарство медленно
переходит в межтканевую жидкость.
Одним словом, обычно мы имеем дело не с лекарственным веществом, как
таковым, а с так называемой лекарственной формой, и число таких форм увеличивается
с каждым годом. И липосомы это лекарственная форма, и микрогранулы, и неустанно
рекламируемая по телевизору заморская шипучка с аспирином...
Но вот лекарственное вещество внутри нас. Прежде всего, нужно быть уверенным,
что оно либо не обладает незапланированными биологическими активностями,
либо эти активности минимальны. Проверка этого длится годами, используют
десятки тестов. В качестве подопытных организмов используют, разумеется
различных животных, каждый раз детально анализируя переносимость полученных
результатов на человека (кстати, часто лучшая модель человека - свинья).
Некоторые тесты, например, проверка на канцерогенность требуют наблюдения
за животным вплоть до его естественной смерти.
Бывает, к счастью, редко, что столь тщательная система фильтрации дает
сбой, и тогда последствия могут быть трагическими... В свое время весь
мир потрясла история с талидомидом, казалось, безвредным болеутоляющим
и успокаивающим средством, которое уродовало детей в утробе беременных
женщин. Фотографии жертв талидомида, с укороченными и недоразвитыми конечностями
вроде ласт, взбудоражили парламенты и, нет худа без добра, привели к законодательным
актам, еще более ужесточившим проверку новых лекарств на вредность.
Если препарат рассчитан на исцеление больного, то следует также проконтролировать
его выведение из организма (шутка!). Мало того, что сам он может повредить
главный орган выделения - почки, часто много забот вызывают продукты его
метаболических превращений. Эти превращения, особенно гидрофобных соединений,
происходят в печени с участием широкого набора малоспецифичных ферментов
- цитохромов Р-450. Почти все чужеродные органические соединения (ксенобиотики),
попадающие в нашу печень, встречают среди изоформ Р-450 хоть одну, которая
способна окислить их молекулы.
Суть работы цитохрома Р-450 состоит в том, что он связывает О2
и восстанавливает его в некий эквивалент описанных выше активных форм кислорода.
Именно в таком активированном состоянии фермент окисляет связанный субстрат,
а, если сделать это ему не удается, то он способен генерировать подлинные
активные формы кислорода.
И то, и другое сопряжено со значительным риском для организма. Например.
тетрахлордибензодиоксины обязаны своей легендарно высокой токсичностью
как раз устойчивостью к окислению цитохромами Р-450. Организм повреждают
не сами эти вещества, а активные формы кислорода - фермент продуцирует
их в тщетных стараниях окислить прочно связывающийся с ним диоксин.
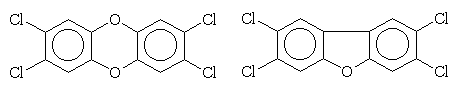
Тетрахлорзамещенных дибензодиоксинов
и дибензофуранов не было в окружающей нас природе, пока на химических заводах
не начали производить полихлорфенолы, а нерадивые дворники не стали сжигать
хлорвиниловую упаковку на помойках. Эти вещества сами по себе не токсичны,
но даже в ничтожных количествах они побуждают организм производить активные
формы кислорода, повреждающие биомолекулы и потому вызывающие тяжелейшие
заболевания. |
С другой стороны, продукты первичного окисления ксенобиотиков тоже могут
оказаться крайне вредными. Например, безобидныый сам по себе четыреххлористый
углерод при окислении цитохромом Р-450 превращается в активный свободный
радикал CCl3·, инициирующий губительное перекисное
окисление в мембранах. Многие ароматические амины и полициклические углеволороды
окисляются в реакционноспособные вещества. С этим связана печальная известность
таких химических канцерогенов как дибензпирен, бензидин, а также многих
красителей, ныне исключенных из числа пищевых. Мало того, первичные продукты
окисления способны "пришиваться" к белкам, становясь, таким образом,
гаптенами, вызывающими иммунный ответ. Часто именно такова природа аллергической
реакции на лекарства.
Но даже в том случае, когда эти неприятности удается избежать, цитохромы
Р-450 все равно создают проблемы для фармакологов, не говоря уже о больных.
Дело в том, что эти ферменты принадлежат к числу индуцируемых. Иными словами
при повторных попаданиях субстрата в организм их количество быстро возрастает,
а содержание субстрата там уменьшается с каждым разом все быстрее. Это
явление, применительно к лекарствам, приводит к уменьшению их эффективности,
которое в просторечии зовут привыканием.
Вспомним, наконец, что в промежутке между попаданием лекарства в организм
и его выводом его оттуда оно все-таки должно лечить. А для этого лекарство
должно добраться до своей мишени и взаимодействовать с ней. Некоторых связанных
с этим проблем мы коснулись выше, но большинство осталось в тени.
Вот, к примеру, одни патогенные микробы плодятся на эпителии, другие
в лимфатических узлах, третьи в кровяном русле, четвертые внутри клеток
хозяина... Если мы хотим достичь максимальной стационарной концентрации
лекарственного вещества в каждом из этих мест, необходимо позаботиться,
чтобы молекулы преодолели совершенно разные диффузионные барьеры. Требуется
глубокое понимание физиологии и биохимии, чтобы направленно воздействовать
на эти процессы. А ведь антибактериальное лекарство еще должно попасть
внутрь микробной клетки.
В свое время, например, выяснили, что аналоги хлорамфеникола, содержащие
вместо дихлорацетильного другие ацильные остатки, прекрасно ингибируют
трансляцию на бактериальных рибосомах -- но только в бесклеточных системах.
В клетки бактерий они просто не не проникают. Так что повторю еще раз:
долог путь от ингибитора до лекарства!
Это "две большие разницы": пробирочная и физиологическая биохимия.
Взять хотя бы простую на первый взгляд проблему стехиометрических соотношений.
Рецептор и лиганд взаимодействуют в большинстве случаев эквимолярно. Однако
отсюда вовсе не следует, что при таком соотношении обоих компонентов в
системе все рецепторы будут связаны с лигандами. Доля занятых рецепторов
определяется константой диссоциации соответствующих комплексов. Если она
велика, то для насыщения всех рецепторов нужен большой избыток лиганда.
Ясно, что, применительно к лекарствам, это плохо. Но так же невыгодной
может быть обратная ситуация, когда связывание лиганда практически необратимо.
Ведь это означает, что данный рецептор блокирован навсегда, и восстановление
его функции требует биосинтеза нового рецептора!
И, пожалуй, самое ответственное дело. Перед введением лекарства в широкую
медицинскую практику совершенно обязательно располагать сведениями о наиболее
предпочтительных дозировках. О совместимости с другими лекарствами, излечивающими
от той же болезни. О совместимости с другими лекарствами, лечащими от других
болезней (представьте диабетика с язвой желудка, который вскоре после инфаркта
миокарда заразился ангиной). О применении при самых разных патологических
состояниях или врожденных отклонениях от нормы. И так далее... Подобные
сведения добываются, главным образом, при клинических испытании нового
препарата, которые неизбежно сопряжены с определенным риском и для пациентов,
и для медиков.
Велика цена, которую приходится платить за эти знания, но только они
могут обеспечить эффективность и безопасность лечения множества людей,
включая нас с вами. Врач изучает, и очень внимательно, таблицы дозировок
и список противопоказаний на листочке, приложенном к каждому путному лекарству,
либо в профессиональных справочниках (непременно самых свежих). Разбираться
в этих данных и делать правильные выводы врачей учат не один год и не один
раз. А мы, прочие, обязаны признать свое невежество в этих проблемах и
никогда не заниматься лекарственным самолечением! Даже подростковых угрей...
А как быть с приметами нашего капитализма: вкрадчивыми "независимыми"
экспертами на радио, холеными красотками на телеэкране, плакатным глянцем
в метро? Ведь реклама лекарств в красивых коробочках, снабженных крышечкой
и ложечкой, явно обращена не к врачам, а к больным... Рецепт прост: задумайтесь
о некоторой двусмысленности известной поговорки: "Лекарства дороги,
но жизнь дороже!"
12. Лекарства
в реальном мире
Можно ли после всего сказанного удивляться, что в наши дни созданием
новых лекарств могут заниматься только очень крупные и очень богатые организации.
Как правило, это мощные фармацевтические фирмы. Уделом одиночек и отдельных
исследовательских лабораторий остается либо формулирование новых идей,
либо поиск прототипов. Огромные деньги и многолетний труд, затрачиваемые
на пути от идеи до лекарственной формы, прошедшей все испытания, объясняют,
почему фармацевтические фирмы не только охраняют свои секреты пуще иных
правительственных спецслужб, но и сами ловят любой неосторожный разговор
или намек, позволяющий им сократить расходы и опередить конкурентов.
Надеюсь, вы теперь иначе станете относиться к тем, кто поносит за косность
и бюрократизм ужасное наследие советского тоталитаризма - Фармкомитет,
без санкции которого новым препаратам пока, слава Богу, закрыта дорога
в больницы и на аптечные прилавки. Усердие журналистов, проталкивающих
знахарей и шарлатанов с их снадобиями, тем более настораживает, что этим,
вовсе не темным людям отлично известно: дотошность и кажущийся консерватизм
Фармкомитета - детская игра по сравнению, скажем, с придирчивостью аналогичного
учреждения в США - Food and Drugs Administration. Мне рассказывали
очевидцы, что документация, которую туда представляет фирма по новому препарату,
весит около тонны.
И далеко не всегда по невежеству или из экономии врачи бывают врачи
осторожны в применении новейших лекарств. Они знают, что неприятные последствия
могут проявиться через многие годы, и не рискуют здоровьем своих пациентов,
помнят о шумно рекламировавшемся талидомиде. Помнят о страждущих похудеть,
которые слепли от динитрофенола, и о туберкулезниках, которые глохли, пока
медики не научились правильно дозировать им стрептомицин. А самые образованные
врачи помнят и о том, что одна из фирм, разработавших пероральные гормональные
контрацептивы, сначала по дешевке распространила их в Мексике и, лишь проследив
отдаленные результаты, начала продавать в США.
Я знаю, о чем подумает каждый третий читатель: "Слышал, есть
бабка, которая все лечит, и без этих хитростей!" А каждый второй скажет
про себя: "Чем глотать эти опасные таблетки, лучше выпить, чего покрепче,
а то пойти в баню..." Дай вам Бог, если и болеть, то только такими
болезнями, для лечения которых этих домашних средств вполне достаточно.
И дай вам Бог удачи отличить эти болезни от других, которые-таки требуют
для лечения те самые таблетки.