№7, 1982 г.
№7, 1982 г.
Публикуемая здесь статья не принадлежит к числу научно-популярных. Это - текст первого сообщения о замечательном открытии: периодически действующей, колебательной химической реакции. Текст этот напечатан не был. Автор послал свою рукопись в 1951 году в научный журнал. Редакция отправила статью на рецензию и получила отрицательный отзыв. Основание: описанная в статье реакция невозможна... Только в 1959 году в малоизвестном сборнике был напечатан краткий реферат. Редакция "Химии и жизни" предоставляет читателю возможность познакомиться с текстом и необычной судьбой первого сообщения о большом открытии.Академик И.В. Петрянов
ПЕРИОДИЧЕСКИ ДЕЙСТВУЮЩАЯ РЕАКЦИЯ
И ЕЕ МЕХАНИЗМБ.П. Белоусов
Как известно, медленно протекающие окислительно-восстановительные реакции можно весьма заметно ускорить, например путем введения относительно небольших количеств третьего вещества - катализатора. Последний изыскивается обычно эмпирически и является для данной реакционной системы до известной степени специфическим.
Некоторую помощь в изыскании такого катализатора может оказать правило, по которому нормальный его потенциал подбирается средним между потенциалами реагирующих в системе веществ. Указанное правило хотя и упрощает выбор катализатора, однако оно еще не позволяет заранее и с уверенностью предсказывать, будет ли таким образом выбранное вещество действительно являться положительным катализатором для данной окислительно-восстановительной системы, а в случае, если и будет пригодным, то еще неизвестно, в какой мере оно проявит свое активное действие в избранной системе.
Надо полагать, что так или иначе изысканный катализатор окажет действие как в своей окислительной форме, так и в восстановленной. Причем окисленная форма катализатора, очевидно, должна легко реагировать с восстановителем основной реакции, а его восстановленная форма - с окислителем.
В системе бромата с цитратом ионы церия вполне отвечают указанным выше условиям, а потому, при подходящем рН раствора, могут являться хорошими катализаторами. Отметим, что в отсутствие ионов церия сам бромат практически не способен окислять цитрат, тогда как четырехвалентный церий достаточно легко это делает. Если принять во внимание способность бромата окислять СeIII в СеIV, становится понятной каталитическая роль церия в такой реакции.
Поставленные в этом направлении опыты подтвердили каталитическую роль церия в избранной системе, а кроме того, выявили поразительную особенность течения этой реакции.
Действительно, нижеописываемая реакция замечательна тем, что при проведении ее в реакционной смеси возникает ряд скрытых, упорядоченных в определенной последовательности окислительно-восстановительных процессов, один из которых периодически выявляется отчетливым временным изменением цвета всей взятой реакционной смеси. Такое чередующееся изменение окраски, от бесцветной до желтой и наоборот, наблюдается неопределенно долго (час и больше), если составные части реакционного раствора были взяты в определенных количествах и в соответствующем общем разведении.
Например, периодическое изменение окраски можно наблюдать в 10 мл водного раствора следующего состава *:
лимонная кислота
сульфат церия
бромат калия
серная кислота (1:3)
воды до общего объема2,00 г
0,16 г
0,20 г
2,0 мл
10,0 млЕсли указанный, комнатной температуры, раствор хорошо перемешан то в растворе в первый момент усматривается возникновение нескольких быстрых смен окрасок из желтого в бесцветный и наоборот, которые спустя 2-3 минуты приобретают правильный ритм.
* При желании изменить темп пульсации приведенная пропись состава реакционного раствора в известной мере может быть изменена. Указанные в тексте количественные соотношения ингредиентов, входящих в состав описываемой реакции, были экспериментально разработаны А.П. Сафроновым. Им же предложен для этой реакции индикатор - фенантролин / железо. За что автор весьма ему признателен.При соблюдении условий опыта продолжительность одной смены окраски имеет среднее значение, равное примерно 80 с. Однако этот интервал через некоторое время (10-15 мин) имеет тенденцию увеличиваться и с 80 с постепенно доходит до 2-3 мин и более. В это же время отмечается появление в растворе тонкой белой взвеси, которая со временем частично седиментирует и выпадает на дно сосуда в виде белого осадка. Анализ его показывает образование пентабромацетона, как продукта окисления и бромирования лимонной кислоты. Увеличение концентрации ионов водорода или церия весьма ускоряет ритм реакции; при этом интервалы между импульсами (сменой окраски) становятся короче; одновременно наступает быстрое выделение значительных количеств пентабромацетона и двуокиси углерода, что влечет за собой резкое уменьшение лимонной кислоты и бромата в растворе. В таких случаях реакция заметно приближается к концу, что усматривается по вялости ритма и отсутствию четких смен окрасок. В зависимости от израсходованного продукта добавка бромата или лимонной кислоты вновь возбуждает интенсивность затухающих импульсов и заметно продлевает всю реакцию. На течение реакции большое влияние оказывает также и повышение температуры реакционной смеси, которое сильно ускоряет ритм импульсов; напротив, охлаждение затормаживает процесс.Некоторое нарушение течения реакции, а с этим и равномерности ритма, наблюдаемое спустя некоторое время от начала процесса, зависит, вероятно, от образования и накапливания твердой фазы, суспензии пентабромацетона.
На самом деле, ввиду способности ацетонпентабромида сорбировать и удерживать на себе небольшую часть выделяющегося при импульсах свободного брома (см. ниже), последний, очевидно, будет частично выбывать из этого звена реакции; напротив, при очередной смене импульса, когда раствор станет бесцветным, сорбированный бром станет медленно десорбироваться в раствор и неупорядоченно идти в реакцию, нарушая тем самым создавшуюся вначале общую синхронность процесса.
Таким образом, чем больше накапливается взвеси пентабромацетона, тем больше наблюдаются и нарушения в длительности ритма: бремя между сценами окрасок раствора увеличивается, а сами смены становятся нечеткими.
Сопоставление и анализ экспериментальных данных свидетельствуют, что в основе этой реакции лежит своеобразное поведение лимонной кислоты по отношению к некоторым окислителям.
Если мы имеем подкисленный серной кислотой водный раствор лимонной кислоты, к которому добавлены КВrО3 и соль церия, то, очевидно, в первую очередь должна протекать следующая реакция:
1 ) HOOC-CH2-C(OH)(COOH)-CH2-COOH + Ce4+ ® HOOC-CH2-CO-CH2-COOH + Ce3+ + CO2 + H2O
Эта реакция достаточно медленная, в ней усматривается (по исчезновению желтой окраски, свойственной ионам Ce4+) постепенное накопление трехвалентного иона церия.
Образующийся трехвалентный церий будет взаимодействовать с броматом:
2) Ce3+ + BrО3- ® Ce4+ + Вr -.
Эта реакция более медленная, чем предыдущая (1), так как весь образующийся Ce4+ успевает вернуться в реакцию 1 на окисление лимонной кислоты, а потому окраски (от Ce4+) не наблюдается.
Далее, очевидно, накапливающийся Br - (реакция 2) будет реагировать с броматом:
3) Вr - + BrО3- ® BrO- + BrО2-.
Реакция относительно быстрая ввиду большой концентрации Н+; за ней следуют еще более быстрые процессы:
а) Вr - + BrO- ® Br2
б) 3Вr - + BrО2- ® 2Br2
Однако выделения свободного брома пока еще не отмечается, хотя он и образуется. Это происходит, очевидно, потому, что в реакции 2 бромид накапливается медленно; таким образом, "свободного" брома мало, и он успевает расходоваться в быстрой реакции 4 с ацетондикарбоновой кислотой (образовавшейся в реакции 1).
4) HOOC-CH2-CO-CH2-COOH + 5Br2 ® Br3C-CO-CHBr2 + 5Вr - + 2CO2 + 5H+
Здесь, очевидно, окраска раствора также будет отсутствовать; причем раствор может слабо замутневать от образовавшегося малорастворимого ацетонпентабромида. Выделение газа (CO2) пока еще незаметно.
Наконец, после того как накопилось достаточное количество Br - (реакции 2 и 4), наступает момент взаимодействия бромида с броматом, теперь уже с видимым выделением некоторой порции свободного брома. Ясно, что к данному моменту ацетондикарбоновая кислота (которая до этого "блокировала" свободный бром) успеет израсходоваться вследствие малой скорости ее накопления в реакции 1.
Выделение свободного брома происходит спонтанно, и это обусловливает внезапную окраску всего раствора, которая усилится, вероятно, и от одновременного возникновения желтых ионов четырехвалентного церия. Выделившийся свободный бром будет постепенно, но с хорошо заметной скоростью расходоваться на образование ионов Ce4+ (потребляемых реакцией 1), а следовательно, и на реакцию 3. Возможно, бром также будет расходоваться и на взаимодействие с лимонной кислотой в присутствии
BrО3- *, так как при этом не исключается роль возникающих побочных процессов, индуцирующих эту реакцию.* Если в водном растворе H2SO4 (1:3) имеются только лишь лимонная кислота и бромат, то при слабом нагревании такого раствора (35-40°) и прибавлении бромной воды раствор быстро становится мутным, а бром исчезает. Последующее извлечение взвеси эфиром показывает образование ацетонпентабромида. Следы солей церия очень ускоряют этот процесс при бурном выделении СО.После исчезновения свободного брома и ионов Ce3+ в реакционном растворе, очевидно, останутся неактивный ацетонпентабромид, взятый избыток лимонной кислоты и бромата, а также катализирующий процесс четырехвалентный церий. Не подлежит сомнению, что в этом случае вышеописанные реакции пойдут опять сызнова и будут повторяться до тех пор, пока не израсходуется один из ингредиентов взятой реакционной смеси, т.е. лимонная кислота или бромат *.* В том случае, когда реакция остановилась в силу израсходования одного из ингредиентов, прибавление израсходованного вещества опять возобновит периодические процессы.Так как из имеющих место многочисленных процессов только немногие определяются визуально в виде смены окраски, то была сдалана попытка выявить скрыто протекающие реакции с помощью осциллографа.Действительно, на осциллографических снимках усматривается ряд периодических процессов, которые, очевидно, должны соответствовать видимым и скрытым реакциям (см. рисунок). Однако последние требуют еще детального анализа.
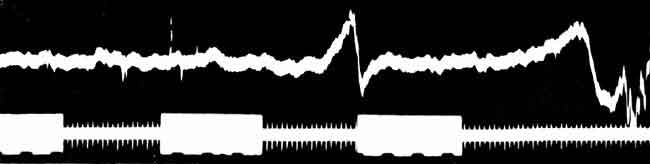
Одна из первых осциллограмм периодической реакции, полученная Б.П. Белоусовым (публикуется впервые)
В заключение отметим, что более отчетливое изменение цветности периодической реакции наблюдается с применением индикатора на окислительно-восстановительные процессы. В качестве такового наиболее удобным оказался железофенантролин, рекомендованный для определения перехода Ce4+ в Ce3+. Мы применяли на 10 мл реакционной смеси 0,1-0,2 мл реактива (1,0 г о-фенантролина, 5 мл H2SO4 (1:3) и 0,8 г соли Мора в 50 мл воды). При этом бесцветной окраске раствора (Ce3+) соответствовала красная форма индикатора, а желтой (Ce4+) - синяя.
Особенно ценным такой индикатор явился для демонстрационных целей. Например, эта реакция чрезвычайно эффективна при демонстрации изменения ее скорости в зависимости от температуры.
Если сосуд с реакционной жидкостью, показывающей нормальное число импульсов (1-2 в мин), нагреть, то наблюдается быстрое изменение в скорости чередования смены окрасок, доходящее до полного исчезновения интервалов между импульсами. При охлаждении ритм реакции вновь замедляется и перемена цветов становится опять отчетливо различимой.
Другую своеобразную картину пульсирующей реакции с применением индикатора удается наблюдать, если реакционный раствор, находящийся в цилиндрическом сосуде и "настроенный" на быстрый темп, аккуратно разбавить водой (путем наслоения) с таким расчетом, чтобы концентрация реагирующих веществ постепенно убывала от дна сосуда к верхнему уровню жидкости.
При таком разведении наибольшая скорость пульсации будет в более концентрированном нижнем (горизонтальном) слое, убывая от слоя к слою к поверхности уровня жидкости. Таким образом, если в каком-либо слое в какое-то время произошла смена окраски, то одновременно в выше- или нижележащем слое можно ожидать отсутствие таковой или иную окраску. Это соображение несомненно приложимо ко всем слоям пульсирующей жидкости. Если при этом учесть способность суспензии выпадающего пентабромацетона селективно сорбировать и длительно удерживать на себе восстановленную красную форму индикатора, то красная окраска пентабромацетона будет закреплена в слое. Она не нарушается даже при последующем изменении окислительно-восстановительного потенциала среды. В результате чего вся жидкость в сосуде через некоторое время становится пронизанной горизонтальными красного цвета слоями.
Следует указать, что введение в нашу систему другой окислительно-восстановительной пары: Fe2+ + Fe3+ - не может, конечно, не отразиться на первой.
В ней при этом отмечается более быстрое выделение ацетонпентабромида и соответственно более скорое завершение всего процесса.
ИТОГИ
Открыта периодическая, длительно протекающая (пульсирующая) реакция.
На основе наблюдения картины реакции и анализа фактического материала предложены соображения об узловых моментах механизма ее действия.
1951-1957 гг.
Равнодушное перо рецензента
Похвастать тем, что им доводилось читать эту статью, могут очень немногие даже среди химиков. Судьба единственной доступной всеобщему прочтению публикации Бориса Павловича Белоусова так же необычна, как судьба ее автора - лауреата Ленинской премии 1980 года. Признание заслуг этого замечательного ученого не застало его в живых - Белоусов скончался в 1970 году, в возрасте 77 лет.Говорят, что открытия революционного для науки значения могут делать только молодые - а Борис Павлович открыл первую колебательную реакцию в 57 лет. Зато открыл не по случайному стечению обстоятельств, а совершенно сознательно, пытаясь создать простую химическую модель некоторых стадий цикла Кребса*. Опытный исследователь, он сразу оценил значение своих наблюдений. Белоусов неоднократно подчеркивал, что открытая им реакция имеет прямые аналогии с процессами, происходящими в живой клетке.
* Цикл Кребса - система ключевых биохимических превращений карбоновых кислот в клетке.В 1951 году, решив, что первый этап исследования завершен, Белоусов попытался опубликовать сообщение об этой реакции в одном из химических журналов. Однако статья принята не была, так как получила отрицательный отзыв рецензента. В отзыве говорилось, что публиковать ее не следует, потому что описанная в ней реакция невозможна.Знать бы этому рецензенту, что существование колебательных реакций предсказано еще в 1910 году А. Лоткой, что с тех пор существует математическая теория подобного рода периодических процессов. Да и эти премудрости знать было необязательно - рецензент-химик мог, в конце концов, взять в руки пробирку и смешать в ней нехитрые компоненты, описанные в статье. Однако обычай проверять сообщения коллег экспериментом давно забыт - так же, как (к сожалению!) и обычай доверять их научной добросовестности. Белоусову просто не поверили, и он был этим очень оскорблен. Рецензент писал, что сообщение о "якобы обнаруженном" явлении можно было бы опубликовать только при условии его теоретического объяснения. При этом подразумевалось, что такое объяснение невозможно. А как раз в то время к работам А. Лотки и В. Вольтерра, развившего теорию Лотки применительно к биологическим процессам (модель "хищник - жертва" с незатухающими колебаниями численностей видов), к экспериментальным и теоретическим исследованиям Д.А. Франк-Каменецкого (1940 г.) прибавились работы И. Христиансена, прямо призывавшего к поиску периодических химических реакций ввиду их полной научной вероятности.
Несмотря на отказ опубликовать работу, Белоусов продолжал изучать периодическую реакцию. Так появилась та часть его статьи, в которой используется шлейфовый осциллограф. Были зафиксированы изменения ЭДС системы за время реакционного цикла, были обнаружены быстрые периодические процессы, происходящие на фоне наблюдаемых простым глазом более медленных.
Повторная попытка опубликовать статью об этих явлениях была предпринята в 1957 году. И снова рецензент - на этот раз другого химического журнала - статью забраковал. На этот раз равнодушное перо рецензента породило следующую версию. Схема реакции, говорилось в отзыве, не подтверждена кинетическими расчетами. Публиковать можно, но только при условии сокращения до объема письма в редакцию.
Оба требования были нереальны. Обоснование кинетической схемы процесса в дальнейшем потребовало десятилетних трудов многих исследователей. Сократить же статью до 1-2 машинописных страниц означало сделать ее попросту невразумительной.
Вторая рецензия привела Белоусова в мрачное настроение. Он решил вообще отказаться от публикации своего открытия. Так сложилась парадоксальная ситуация. Открытие было сделано, о нем среди московских химиков ползали туманные слухи, а, в чем оно состоит и кто его сделал, никто не знал.
Одному из нас пришлось затеять "шерлок-холмсовский" розыск. Долгое время поиски были безрезультатны, пока на одном из научных семинаров не удалось установить, что автор разыскиваемой работы - Белоусов. Лишь после этого открылась возможность связаться с Борисом Павловичем и начать его уговаривать, чтобы он свои наблюдения в какой-либо форме опубликовал. После долгих уговоров удалось, наконец, заставить Бориса Павловича опубликовать краткую версию статьи в "Сборнике рефератов по радиационной медицине", издаваемом Институтом биофизики МЗ СССР. Статья увидела свет в 1959 году, однако малый тираж сборника и небольшая его распространенность сделали ее почти недоступной для коллег.
Тем временем периодические реакции интенсивно изучались. В работу включилась кафедра биофизики физического факультета МГУ, а затем и лаборатория физической биохимии в Институте биофизики АН СССР в Пущино. Существенный прогресс в понимании механизма реакции начался с появлением работ А.М. Жаботинского. Однако то обстоятельство, что сообщение Белоусова было опубликовано в урезанной форме, до некоторой степени тормозило ход исследований. Многие детали эксперимента его последователи порой должны были открывать для себя заново. Так было, например, с индикатором - комплексом железа с фенантролином, который оставался забытым до 1968 года, а также с "волнами" окраски.
А.М. Жаботинский показал, что бром в заметных количествах в колебательной реакции не образуется, установил ключевую роль бромид-иона, обеспечивающего "обратную связь" в этой системе. Им и его сотрудниками было найдено восемь различных восстановителей, способных поддерживать колебательную реакцию, а также три катализатора. Была детально изучена кинетика некоторых стадий, составляющих в сумме этот весьма сложный и в деталях по сей день неясный процесс.
За прошедшие со времени открытия Б.П. Белоусова 30 лет был обнаружен обширный класс колебательных реакций окисления органических веществ броматом. В общих чертах их механизм описывается следующим образом.
В ходе реакции бромат окисляет восстановитель (в качестве восстановителя Б.П. Белоусов использовал лимонную кислоту). Однако это происходит не непосредственно, а с помощью катализатора (Б.П. Белоусов использовал церий). При этом в системе происходят два основных процесса:
1) окисление восстановленной формы катализатора броматом:
HBrO3 + Саtn+ ® Cat(n+1)+ + ...
2) восстановление окисленной формы катализатора восстановителем:
Cat(n+1)+ + Red ® Cat"+ Саtn+ + Br - + ...
В ходе второго процесса выделяется бромид (из исходного восстановителя или из его бром-производных, образующихся в системе). Бромид является ингибитором первого процесса. Таким образом, в системе имеется обратная связь и возможность установления режима, в котором концентрация каждой из форм катализатора периодически колеблется. В настоящее время известно около десяти катализаторов и более двадцати восстановителей, способных поддерживать колебательную реакцию. Среди последних наиболее популярны малоновая и броммалоновая кислоты.
При исследовании реакции Белоусова были обнаружены сложно-периодические режимы и режимы, близкие к стохастическим.
При проведении этой реакции в тонком слое без перемешивания А.Н. Заикиным и А.М. Жаботинским были обнаружены автоволновые режимы с источниками типа ведущего центра и ревербератора (см. "Химия и жизнь", 1980, № 4). Достаточно полное представление достигнуто о процессе окисления катализатора броматом. Наименее ясным сейчас представляется механизм производства бромида и осуществления обратной связи.
За последние годы, кроме обнаружения новых восстановителей для колебательных реакций, был открыт новый интересный класс колебательных реакций, не содержащих ионов переходных металлов в качестве катализатора. Механизм этих реакций предполагается аналогичным описанному выше. При этом считается, что в роли катализатора выступает одно из промежуточных соединений. В этих системах гакже обнаружены автоволновые режимы.
Класс реакций Белоусова интересен не только тем, что он представляет собой нетривиальное химическое явление, но и тем, что он служит удобной моделью для изучения колебательных и волновых процессов в активных средах. Сюда относятся периодические процессы клеточного метаболизма; волны активности в сердечной ткани и в ткани мозга; процессы, происходящие на уровне морфогенеза и на уровне экологических систем.
Число публикаций, посвященных реакциям Белоусова - Жаботинского (таково ныне общепринятое название этого класса химических колебательных процессов), измеряется сотнями, притом немалую его часть составляют монографии и фундаментальные теоретические исследования. Закономерным итогом этой истории явилось присуждение Б.П. Белоусову, Г.Р. Иваницкому, В.И. Кринскому, А.М. Жаботинскому и А.Н. Заикину Ленинской премии.
В заключение нельзя не сказать несколько слов об ответственной работе рецензентов. Никто не спорит с тем, что к сообщениям об открытии принципиально новых, ранее невиданных явлений надо относиться с осторожностью. Но можно ли в пылу "борьбы с лженаукой" впадать в другую крайность: не давая себе труда проверить необычное сообщение со всей добросовестностью, а руководствуясь лишь интуицией и предубеждением, отвергать его на корню? Не тормозит ли такая рецензентская поспешность развитие науки? Надо, видимо, с большей осторожностью и тактом реагировать на сообщения о "странных", но не опровергаемых экспериментально и теоретически явлениях.
Доктор биологических наук С.Э. Шноль,
кандидат химических наук Б.Р. Смирнов,
кандидат физико-математических наук Г.И. Задонский,
кандидат физико-математических наук А.Б. Ровинский
ЧТО ЧИТАТЬ О КОЛЕБАТЕЛЬНЫХ РЕАКЦИЯХ
А. М. Жаботинский. Периодический ход окисления малоновой кислоты в растворе (Исследование реакции Белоусова). - Биофизика, 1964, т. 9, вып. 3, с. 306-311.
A.N. Zaikin, A.М. Zhabotinskii. Concentrational Wave Propagation in Two-Dimensional liquid-phase Self-oscillating System. - Nature, 1970, v. 225, p. 535-537.
А.М. Жаботинский. Концентрационные автоколебания. М., "Наука", 1974.
Г.Р. Иваницкий, В.И.Кринский, Е.Е.Сельков. Математическая биофизика клетки. М., "Наука", 1977.
R.М. Nоyes. Oscillations in Homogeneous Systems. - Ber. Bunsenges. Phys. Chem., 1980, В. 84, S. 295-303.
A.М. Zhаbotinskii. Oscillating Bromate Oxidative Reactions. - I bid. S. 303-308.