т. 73, № 5, с. 412 (2003)
| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
т. 73, № 5, с. 412 (2003) |
БИОЧИПЫ В БИОЛОГИИ И МЕДИЦИНЕ XXI ВЕКА
Академик А.Д. Мирзабеков
Выступление на научной сессии общего собрания РАН
(По техническим причинам часть рисунков не воспроизведена - V.V.)
Биологические микрочипы являются одним из наиболее быстро развивающихся экспериментальных направлений современной биологии. Существует два основных типа биочипов [1]. Первый тип, рассматриваемый в настоящей статье, - это микроматрицы различных соединений, главным образом биополимеров, иммобилизованных на поверхности стекла, в микрокаплях геля, в микрокапиллярах. Другим типом биочипов являются миниатюризованные "микролаборатории". Эффективность биочипов обусловлена возможностью параллельного проведения огромного количества специфических реакций и взаимодействий молекул биополимеров, таких как ДНК, белки, полисахариды, друг с другом и низкомолекулярными лигандами. Удается в достаточно простых параллельных экспериментах собрать и обработать на отдельных элементах биочипа огромное количество биологической информации. В этом заключается фундаментальное информационное сходство биочипов с электронными микрочипами. Однако между ними имеется и ряд принципиальных различий.
На рис. 1 показан принцип действия ячейки ДНК или олигонуклеотидного биочипа, основанный на комплементарных взаимодействиях основания аденина (А) с тимином (Т) и гуанина (G) с цитозином (С) в двух нитях ДНК. Если последовательность оснований в одной нити ДНК (или олигонуклеотида) полностью комплементарна последовательности другой нити, то образуется стабильная совершенная двухнитчатая спираль - дуплекс. Однако присутствие в дуплексе даже одной неправильной пары, например G-G, предотвращает образование дуплекса. Если иммобилизовать в одном из элементов микрочипа специфическую одноцепочечную ДНК или, положим, 20-мерный олигонуклеотид (пробу), то при добавлении к микрочипу меченных флюоресцентными красителями фрагментов ДНК, например генома человека, будет происходить их высокоспецифичное взаимодействие. Заданный олигонуклеотидный элемент биочипа специфически свяжет только одну комплементарную последовательность из 420 = 1.09 х 1012 всех возможных последовательностей этой длины в ДНК. В результате флюоресцентное свечение наблюдается только на этом комплементарном элементе биочипа. Таким образом, один элемент биочипа производит одну выборку примерно из триллиона возможных вариантов, в отличие от элемента электронного чипа, где происходит двоичная выборка: ДА или НЕТ.
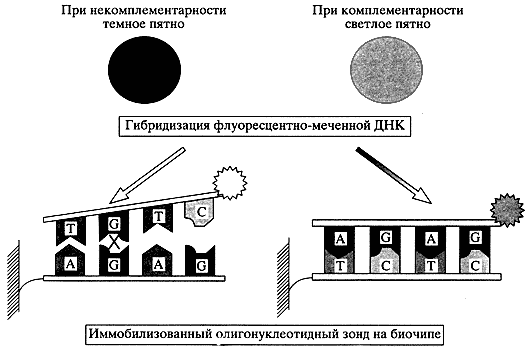
Рис. 1. Схема образования двойной спирали ДНК на биочипе
Олигонуклеотид фиксирован на одном из элементов биочипа и избирательно связывает из многих флуоресцентно меченых фрагментов ДНК только комплементарный. В результате только этот элемент начинает светиться. Это происходит благодаря высоко-специфичным взаимодействиям комплементарных пар нуклеотидов А с Т и G с С. Присутствие некомплементарной пары, например G-G, предотвращает взаимодействие и оставляет элемент микрочипа темнымСтремительное развитие биологии во второй половине прошлого века тесно связано с появлением молекулярной и клеточной биологии, которая основана на концепции о редукционизме -сводимости сложных биологических процессов к процессам, протекающим на уровне отдельных молекул биополимеров, прежде всего белков и нуклеиновых кислот и их различных клеточных комплексов и структур. Редукционизму противопоставлялась концепция интегратизма о необходимости комплексного изучения структуры и функционирования в клетке всей совокупности макромолекул. В последние годы появились такие новые интегративные подходы, как геномика, протеомика и селломика, развиваемые большими коллективами или часто целыми "научными фабриками". Эти направления позволяют устанавливать структуру и изучать процессы на уровне генов всего генома, белков всей клетки или клеток всей ткани. Развиваемые в последние годы биологические микрочипы позволяют реализовать в доступной форме весьма сложные интегративные подходы геномики, протеомики и селломики. Например, олигонуклеотидные и ДНКовые микрочипы, выпускаемые рядом фирм, позволяют в достаточно простых, доступных отдельным исследователям экспериментах изучать экспрессию большинства генов различных бактерий и многих генов человека. На очереди создание белковых чипов, содержащих большое количество иммобилизованных клеточных белков или специфичных к ним антител.Макроматрицы ДНК и белков иммобилизованных на фильтре, или фиксированных в лунках планшет, были известны достаточно давно. Однако первая работа по ДНКовым микрочипам [2] и одна из первых по белковым микрочипам [3] в современном формате были опубликованы нашей лабораторией в Институте молекулярной биологии им. В.А. Энгельгардта РАН (ИМБ). Этот принципиальный скачок был предложен для использования в новом методе секвенирования ДНК гибридизацией. В 1968 г. Советский Союз, а вслед за ним США и другие страны приняли государственные программы установления полной последовательности всех 3 миллиардов нуклеотидов генома человека. Широко дискутировался вопрос, должна ли эта задача решаться масштабированием существующих подходов или должны быть разработаны новые, более эффективные методы. В связи с временными ограничениями, ученые пошли по пути существенного улучшения и гигантского масштабирования уже существующего метода, основанного на считывании одного нуклеотида за другим с конца коротких фрагментов ДНК. Этот метод в химическом и ферментативном варианте был предложен В. Гилбертом и Ф. Сенгером, которые и разделили Нобелевскую премию за 1967 г. В развитии химического метода большую роль сыграли академики Е.Д. Свердлов и А.Д. Мирзабеков. В своей Нобелевской речи В. Гилберт отметил, что "идея метода пришла только после второго визита А. Мирзабекова" в его лабораторию [4].
Рис. 2. Секвенирование фрагмента ДНК гибридизацией с полным олигонуклеотидным микрочипом, содержащим все 4096 6-меровВ поисках новых подходов к секвенированию ДНК нами, а также независимо двумя другими группами в Англии и Сербии было предложено в 1988 г секвенирование гибридизацией [5]. В этом методе секвенирование проводится не отдельными нуклеотидами, а словами в составе полного "словаря" нуклеотидных слов определенной величины. Такой словарь может содержать все возможные 4096 гексануклеотидов, т.е. шестибуквенных генетических слов. Для нас стала очевидной необходимость создания микрочипов, и в следующем году появилась первая статья, описывающая приготовление и свойства предложенных нами гелевых микрочипов [2]. Позднее нами были созданы полные микрочипные гексануклеотид-ные словари. С этого момента и по настоящее время наша группа сконцентрировалась на развитии биочипов: создании ДНКовых, белковых и клеточных биочипов, на развитии технологий их производства и на их применении в фундаментальных исследованиях и их различных приложениях в медицине, биотехнологии и др. областях. Эти исследования рассмотрены в обзорной работе [6].6-меры микрочипа, образующие при гибридизации с флуоресцентно меченым фрагментом ДНК совершенные дуплексы, интенсивно светятся. Такие соседствующие 6-меры перекрываются на пять нуклеотидов; это перекрывание позволяет однозначно восстановить нуклеотидную последовательность ДНК
Рис. 2 показывает такой полный 6-мерный олигонуклеотидный микрочип и секвенирование на нем 50-нуклеотидного фрагмента ДНК [7]. Для приведенного случая идентификация всех 6-меров, комплементарных к ДНК, и перекрывание соседних 6-меров на пять нуклеотидов позволяет восстановить полную нуклеотидную последовательность ДНК. В действительности метод в данном варианте работает только в части случаев, его широкому применению должно предшествовать решение ряда экспериментальных проблем, которые будут рассмотрены далее. .
ГЕЛЕВЫЕ БИОЧИПЫ, ИХ СВОЙСТВА, ПРОИЗВОДСТВО И АНАЛИЗ
Своеобразием и отличием развиваемых нами биочипов является то, что они представляют собой полусферические капли гидрогеля, фиксированные химической связью на поверхности стекла, пластика или силикона (рис. 3). Различные биомолекулы равномерно распределяются и иммобилизуются химическими связями в объеме геля. Иммобилизация не на двумерной поверхности, а в треххмерном объеме геля дает ряд существенных преимуществ. В десятки и сотни раз увеличивается емкость биочипа на единицу поверхности и соответственно увеличивается чуствительность измерений. Иммобилизованные макромолекулы как бы фиксированы в гомогенной водной среде, составляющей около 95% объема геля. Это исключает их взаимодействие как друг с другом, так и с твердой поверхностью, где гетерофазные процессы с участием фиксированных на ней биомолекул протекают более сложным образом. Это особенно существенно для белковых чипов, поскольку молекулы белков имеют тенденцию денатурации в интерфазе, образованной между твердой поверхностью и водной средой. Наконец, гелевые элементы на воздухе или под маслом превращаются как бы в изолированные микро- и нанолитровые пробирки, в каждой из которых можно проводить индивидуально различные специфические взаимодействия, химические и ферментативные реакции. Благодаря этому гелевые биочипы объединяют в себе свойства и микроматриц и микролабораторий.
Рис. 3. Биочипы для анализа туберкулезных бацилл, резистентных к лекарственным препаратам
a и б - фотографии микрочипа в обычном и флуоресцентном микроскопе, в -микрочип в гибридизационной камереСледует отметить, что решение развивать reлевые биочипы было подготовлено нашей совместной работой 35-летней давности с Л.С. Сандахчиевым, ныне академиком РАН, предложившим фиксировать нуклеиновые кислоты в гидрогелях и проводить в них химические реакции для получения высокоочищенной индивидуальной низкомолекулярной тРНК.
Наша технология производства гелевых биочипов прошла три этапа развития.
Громоздкая и малоэффективная технология первого поколения состояла из пяти стадий и была разработана и запатентована в ИМБ в 1989-1993 гг. Она была перенесена в совместную биочипную лабораторию, организованную ИМБ и Аргонской национальной лабораторией (АНЛ, США) в 1994-2000 гг. и стала технологией первого поколения, была лицензирована американскими фирмами "Моторолой" и "Пакардом". Однако из-за ее несовершенства фирмы стали производить биочипы не как микроматрицы гелевых элементов, а как сплошную поверхность полиакриламидного геля.
В ИМБ за последние три года разработаны технологии производства биочипов второго и третьего поколения. Технология второго поколения состоит из трех этапов: модификация иммобилизуемых биополимеров мономерными группами геля, нанесение раствора этих веществ в смеси с мономерными звеньями геля с помощью игольчатого или пьезоэлектрического робота и, наконец, фотоиндуцированная сополимеризация свободных и связанных с биополимерами молекул мономера [8]. Это приводит к равномерной иммобилизации веществ во всем объеме геля. В еще более простой двухэтапной технологии третьего поколения первая и третья стадии получения биочипов объединены с помощью своеобразной химической реакции.
Достаточно простая, универсальная и дешевая технология третьего поколения позволяет производить даже в лабораторных условиях сотни и в скором будущем тысячи олигонуклеотидных, ДНКовых или белковых микрочипов в день. Разработан также метод получения сополимеризацией микрочипов с размерами гелевых микроячеек до 5х5х5 мкм. Биочипы (рис. 3) содержат от десятков до нескольких тысяч гелевых элементов с иммобилизованными в них соединениями. Элементы микрочипа представляют собой гидрогелевые полусферы (диаметром около 100 мкм), находящиеся на расстоянии 250 мкм друг от друга на гидрофобизованной поверхности стекла. Одноцепочечные ДНК длиной до 200-300 нуклеотидов и белки с массой до 150 кД легко и достаточно быстро диффундируют в гидрогелевые элементы микрочипов специально разработанного состава. Сам биочип помещен в реакционную камеру с капиллярным входом и выходом, в которой можно проводить различные процессы в строго контролируемых условиях.
АНАЛИЗ БИОЧИПОВ
Регистрация происходящих на биочипах процессов осуществляется с помощью флюоресцент-ных, а также в некоторых случаях хемилюминис-центных и масс-спектрометрических методов. Для количественного флюоресцентного анализа нами были разработаны совместно с РНЦ "Государственный оптический институт им. С.И. Вавилова" флюоресцентные широкопольные высоко-апертурные микроскопы, снабженные ПЗС-камерой и компьютером [9]. Прибор позволяет проводить в реакционной камере количественный анализ в реальном времени сразу всех элементов биочипа в автоматическом режиме, одновременно при четырех длинах волн, при заданной или меняющейся температуре. Более 20 таких достаточно дорогих исследовательских анализаторов биочипов поставлены в лаборатории России и США. Для клиник нами разработан более простой и дешевый лазерный анализатор. Он позволяет проводить количественную регистрацию флюоресценции одновременно со всего биочипа с помощью более простой ПЗС-камеры и обрабатывать результаты на прилагаемом портативном компьютере с помощью специально созданных программ.
Хемилюминисцентные методы, хотя и уступают по чувствительности люминесцентным, позволяют значительно упростить и удешевить регистрирующую аппаратуру. Кроме того, разработан специальный метод прямого анализа соединений непосредственно в гелевых элементах с помощью MALDI-TOF масс-спектрометрии. Этот важный в протеомике метод позволяет проводить дополнительную идентификацию взаимодействующих с биочипами соединений по их массе.
ОЛИГОНУКЛЕОТИДНЫЕ И ДНКовые МИКРОЧИПЫ
Процесс комплементарных взаимодействий двух нитей ДНК (гибридизация) осложняется существенно меньшей стабильностью совершенного дуплекса А-Т по сравнению с G-C дуплексом и неодинаковым дестабилизирующим эффектом различных неправильных пар оснований. Поэтому в некоторых типах экспериментов была введено измерение кривых плавления, то есть количественной регистрации флюоресценции параллельно во всех ячейках микрочипа в градиенте повышающейся температуры. Это позволяет вычислить термодинамические параметры образования дуплексов: свободную энергию, энтропию и энтальпию. Проведение таких исследований на производимых нами микрочипах, содержащих всевозможные 6-мерные нуклеотиды (всего их 4096), открывает уникальные возможности. Сейчас измеряются термодинамические параметры для 4096 совершенных гексамерных дуплексов и 73728 дуплексов, содержащих всевозможные неправильные пары оснований во всех положениях гексануклеотидов. Составление полного каталога термодинамических параметров гексамерных дуплексов позволит создать более точную теорию гибридизации и оценить влияние на гибридизацию первичной и вторичной структур в ДНК. Эта теория необходима для практических работ с ДНК и, в свою очередь, будет способствовать завершению развития метода секвенирования ДНК гибридизацией.
Для широкого применения секвенирования ДНК гибридизацией с полными, например 6-мерными или более сложными, микрочипами требуется решение ряда проблем. Важной задачей является надежная дискриминация совершенных и неправильных дуплексов, образующихся на био-чипе, что затруднено различиями в стабильности А-Т и G-C пар оснований. Измерение кривых плавлений дуплексов и применение алгоритмов, вычисляющих поверхность под кривой плавления для каждого дуплекса, увеличивают надежность анализа. Другим серьезным препятствием является частое присутствие в ДНК повторяющихся гексануклеотидных и более длинных последовательностей. Эту частоту можно оценить количественно, измеряя и сравнивания интенсивности флуоресценции различных элементов биочипа.
Гибридизация с полным 6-мерным биочипом становится привлекательным методом для выявления известных и открытия новых мутаций и нуклеотидного полиморфизма в участках ДНК с известной структурой. Последовательная гибридизация с одним и тем же полным биочипом двух фрагментов одного и того же участка генома с известной и анализируемой структурой позволяет выявить различия во флюоресцентной картине и установить структуру и положение измененного основания в ДНК. Таким методом можно выявлять присутствие патогенных мутантов в стандартном штамме полиовируса, используемого как полиомиелитная вакцина [10].
Полные 6-мерные биочипы были также использованы для выявления специфичности ДНК-связывающихся соединений к определенным нуклеотидным последовательностям. Таким способом была изучена специфичность гистоноподоб-ного бактериального белка HU, низкомолекулярного красителя Хекст 33258, а также белка р50 [11], являющегося регулятором транскрипции и трансляции и открытого группой академика Л.П. Овчинникова (рис. 5).
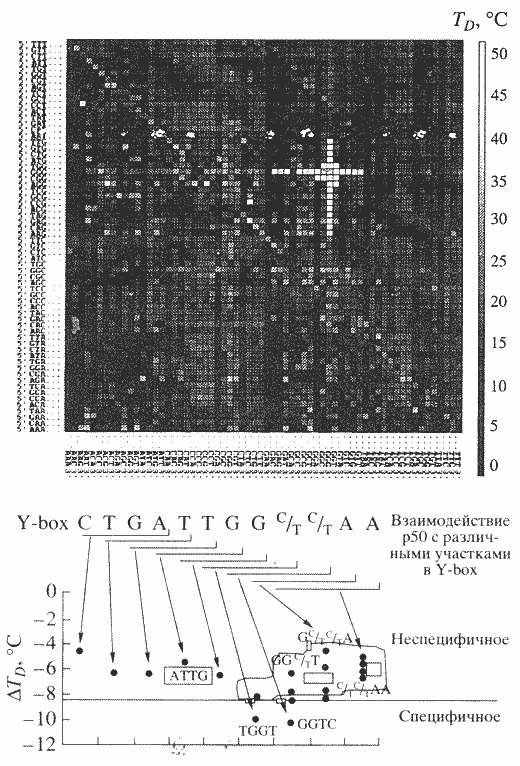
Рис. 5. Идентификация узнавания белком Р50 специфичных участков в ДНК
Флуоресцентно окрашенный белок Р50 связывается с полным 6-мерным олигонуклеотидным микрочипом. Проводиться измерение флуоресценции белка на каждом элементе биочипа в градиенте повышающейся температуры и ТD -температур плавления комплексов белка с олигонуклеотидами. Олигонуклеотиды микрочипа, проявляющие наибольшую температурную стабильность в комплексе с ДНК, локализованные в светлом кресте и содержащие тетрануклеотидные последовательности TGGT и GGTC, демонстрируют также и наибольшую специфичность связыванияГибридизация с олигонуклеотидными микрочипами служит для качественной и количественной идентификации нуклеиновых кислот и для анализа структурных вариаций в них. Рибосомы присутствуют во всех живых клетках, а рибосомальные РНК являются одними из наиболее эволюционно консервативных макромолекул. Вместе с тем в рибосомальных РНК существуют несколько вариабельных участков. Различия в нуклеотидной последовательности этих участков применяются для идентификации микроорганизмов и для прослеживания их эволюции. Нами разработан ряд микрочипов для экспрессного метода идентификации нитрифицирующих бактерий [12], бактерий групп Bacillus [13] и архебактерий. Присутствие рибосомальных РНК в клетке в количестве тысяч копий позволяет проводить анализ в ряде случаев без их амплификации. Разработана также простая система выделения рибосомальных РНК и их флюоресцентного мечения на одной и той же колонке, что позволило создать биочипный экспресс-метод анализа таких типов биологического оружия, как сибирская язва [13]. Мы изучаем также возможность создания биогенов для идентификации всех или большей части известных микроорганизмов.Для качественного и количественного анализа экспрессии генов и содержания различных информационных РНК существует несколько зарубежных коммерческих биочипных систем. Гелевые микрочипы были использованы нами также для анализа мРНК, например, для идентификации хромосомных перестроек, вызывающих восемь различных типов лейкемий [14]. Соответствующая микрочипная диагностика лейкемий внедрена в Детском республиканском гематологическом центре.
Олигонуклеотидные микрочипы являются эффективным подходом для одновременной идентификации от десятков до тысяч генов и их структурного анализа, для выявления специфичных нуклеотидных последовательностей и нуклеотидных вариаций в их структуре. Однако когда гены присутствуют в геноме в количестве одной или нескольких копий, требуется их предварительная амплификация. Наиболее эффективным методом амплификации ДНК является полимеразная цепная реакция, в процессе которой происходит экспоненциальное увеличение количества молекул ДНК от нескольких до миллионов и более копий, достаточных для проведения их гибридизационного анализа.
В более традиционном и простом подходе амплификация ДНК и гибридизация амплифицированной ДНК с биочипом проводятся в две отдельные стадии. Такие двухстадийные методы были разработаны нами в совместных исследованиях с рядом российских и зарубежных лабораторий для идентификации мутаций в b-глобиновом гене, вызывающем наследственное заболевание b-талассемию, определения аллелей в гене гистосовместимости HLA DQAI, нуклеотидного полиморфизма в гене m-опиоидного рецептора [15], обуславливающего, вероятно, склонность к наркомании, определения ряда бактериальных генов, ответственных за резистентность к антибиотикам и синтез некоторых токсинов [16].
Гибридизация амплифицированной ДНК с reлевыми биочипами нашла применение в практике для идентификации мутаций, ответственных за резистентность туберкулезных бацилл к одному из основных противотуберкулезных препаратов - рифампицину [17, 18]. Этот метод прост, недорог и ускоряет анализ от нескольких недель до 1 дня. Метод был разработан совместно с Московским научно-практическим центром борьбы с туберкулезом и ГНЦ вирусологии и биотехнологии "Вектор" и опробован более чем на 150 больных в ряде клиник. Налажен коммерческий выпуск таких наборов для анализа, содержащих олигонуклеотидные микрочипы, компоненты для амплификации ДНК, включая синтетические флюоресцентно меченные олигонуклеотиды, клинический анализатор биочипов с портативным компьютером и программой для автоматического анализа биочипов. Этот метод нетрудно адаптировать для обнаружения многих других микроорганизмов, генов лекарственной резистентности и синтеза токсинов, а также для идентификации различных мутаций в вирусах, микроорганизмах, животных (включая человека) и растениях. Введение соответствующих изменений, необходимых для выполнения этих задач, можно провести за короткое время - от нескольких недель до нескольких месяцев.
В двух других разработанных методах гибридизацию на микрочипе объединяют с амплификацией на микрочипе в одну стадию, что ускоряет и упрощает анализ. Во втором методе [18] амплификация происходит параллельно в растворе в реакционной камере и в гелевых элементах микрочипа, содержащих иммобилизованные и участвующие в амплификации олигонуклеотиды (праймеры). Такой подход был был использован для сокращения идентификации туберкулезной бациллы до 2 часов и определения ее резистентности сразу к двум лекарственным препаратам - рифампицину и изониазиду. В методе используется также аллель-специфичная амплификация, протекающая на иммобилизованных в геле олигонуклеотидах. Помимо этого, мутации и полиморфные нуклеотиды могут выявляться с помощью ферментативных реакций удлинения иммобилизованных на чипе олигонуклеотидов на один нуклеотид и их соединения с другими олигонуклеотидами - лигирования [18].
В третьем методе амплификация происходит исключительно в гелевых элементах микрочипа [19], используемых в этом случае как пробирки объемом от нескольких нанолитров до долей микролитра. Каждая из этих гелевых нанопробирок содержит необходимые для амплификации два и более специфических олигонуклеотида. Метод пока достаточно сложен в исполнении и требует дальнейшей доработки. Однако его реализация позволит анализировать на одном биочипе и в одном эксперименте тысячи полиморфных нуклео-тидов в геноме, что позволит использовать его для массового скрининга популяций. Известно, что полиморфизм примерно 3 млн. нуклеотидов из 3 млрд., составляющих человеческий геном, отличает одного человека от другого. Полиморфизм отвечает за наследственные дефекты и патологии, предрасположенность ко многим заболеваниям, в том числе злокачественным, и определяет многие Другие генетически заданные особенности человека. Поэтому создание простого и эффективного микрочипного анализа полиморфизма сразу по многим участкам для каждого индивидума приблизит человека к цели "Познай самого себя", начертанной приблизительно 2500 лет назад на стене Дельфийского храма в Греции.
Рис. 6. Биочипы, разработанные для идентификации некоторых патогенных бактерий, вирусов и биологического оружия, а также для обнаружения мутаций, вызывающих раковые заболевания
а - вируса натуральной оспы, осповакцины, оспы коров; б - сибирской язвы, чумы, бруцеллеза на одном чипе;
в - детекция патогенов в донорской крови;
г - мутации в ген brcal, ответственных за возникновение рака молочной железы;
д - транслокаций при лейкозах
На рис. 6 показаны другие биочипы, разработанные для идентификации ряда патогенных микроорганизмов и вирусов, а также для выявления ряда вызывающих рак мутаций. Некоторые из этих биочипов могут быть использованы для быстрого и чувствительного выявления биологического оружия, оспы, сибирской язвы и других подобного рода болезней.
Технология производства микрочипов позволяет с небольшими изменениями получать как олигонуклеотидные и ДНКовые, так и белковые микрочипы, содержащие ферменты, антитела, антигены и т.д. [3,20]. Стабилизирующий эффект иммобилизации в геле позволяет хранить большинство белковых микрочипов в течение месяцев без потери функциональной активности.
В сотрудничестве с лабораториями членов-корреспондентов РАН Е.В. Гришина и В.А. Несмеянова (ИБХ, РАН), а также А.Ю. Барышникова (Онкоцентр РАМН) нами было продемонстрировано эффективное применение белковых гелевых чипов для количественной диагностики ряда токсинов, а также раковых антигенов и антител в крови пациентов. Эти начальные эксперименты свидетельствуют, что биочипы конкурентоспособны в клинической иммунодиагностике со стандартными методами.
Перспективно использование белковых чипов в бурно развивающейся протеомике. В этой связи особый интерес представляют следующие две задачи:
• качественное и количественное определение параллельно большого количества белков в клетках различных тканей или в различных функциональных состояниях, для чего можно использовать специфические антитела, как продемонстрировано на рис. 7, для количественной идентификации антигена рака простаты; в ряде стран уже развернуты программы получения большинства белков человеческих и бактериальных клеток и производства специфических антител к ним; мы надеемся использовать отечественную биочипную технологию для сотрудничества с этими программами с целью создания системы количественного определения клеточных белков;• изучение взаимодействий клеточных белков друг с другом и другими клеточными лигандами, такими как ДНК и низкомолекулярные соединения; определение специфичности ДНК связывающихся белков с помощью полных олигонуклеотидных микрочипов описано ранее; значительно более сложной задачей является идентификация белков, специфически взаимодействующих друг с другом и лигандами, если хотя бы один компонент неизвестен; для этих случаев разработан метод идентификации связывающихся с микрочипом молекул с помощью масс-спектрометрии; на белковых микрочипах, содержащих иммобилизованные ферменты, можно проводить также кинетический анализ их субстратов и ингибиторов [3].
Рис. 7. Белковые микрочипы. Антительные микрочипы, разработанные для количественного анализа рака простаты флуоресцентным методомРис. 8. Клеточный биочип, содержащий различные штаммы бактерий, и его использование для качественного и количественного анализа антибиотиков
КЛЕТОЧНЫЕ МИКРОЧИПЫ
Многие прокариотические и эукариотические клетки, как известно, сохраняют свою жизнедеятельность и даже могут делиться, будучи фиксированы в гидрогеле. Это открывает ряд интересных возможностей, в том числе для создания клеточных биочипов как матричных биосенсоров для параллельного определения, например, ряда антибиотиков и ксенобиотиков. На рис. 8 показан такой бактериальный микрочип [21], содержащий иммобилизованные и резистентные к различным антибиотикам штаммы Е. сoli. Фотография прокрашенного гелевого элемента на рис. 8 свидетельствует о распределении растущих клеток по всему объему геля. Кинетика деления и роста бактерий в геле микрочипа регистрируется окрашиванием клеток флюоресцентной краской. Рост бактерий зависит от резистентности клеток к антибиотику и его присутствия в среде. Рисунок показывает бактериальный микрочип, содержащий иммобилизованные в геле 4 штамма Е. coli, чувствительные и резистентные к антибиотикам тетрациклину, хлорамфениколу и смеси хлорамфеникола и ампициллина. Подавление роста бактерий в соответствующих элементах биочипа позволяет идентифицировать присутствие этих антибиотиков в среде. После построения калибровочной кривой содержание антибиотиков в среде может быть измерено количественно. Представляет интерес также создание микрочипов, содержащих животные и растительные клетки для определения широкого диапазона различных веществ в окружающей среде.
Развитие технологии биочипов в Институте молекулярной биологии РАН стало возможным благодаря тесному сотрудничеству исследователей различных специальностей - биологов, химиков, физиков, инженеров, математиков. Эта многогранность была заложена уже при создании института его основателем, академиком В.А. Энгельгардтом. В развитии биочипов участвует в той или иной степени более 12 групп и лабораторий института. Кроме того, с 1991 г. нами проводились совместные исследования и разработки с более чем 40 отечественными и зарубежными исследовательскими и производственными лабораториями и фирмами. Благодаря относительной самодостаточности нам удается продолжать успешную работу и в нынешние, весьма нелегкие для российской науки времена. * * *
Развитие отечественной технологии гелевых биочипов и ее различных практических приложений, начатое с 1989 г., получило значительную поддержку, в том числе финансовую, как в России, так и в США со стороны ряда государственных и частных организаций. Эффективность реализации этих затрат будет определяться широтой и масштабностью использования отечественной технологии в фундаментальных исследованиях и в приложениях в медицине, биотехнологии, сельском хозяйстве, для мониторинга окружающей среды и для борьбы с биотерроризмом. С этой целью при активной поддержке Президиума РАН создается Центр коллективного пользования технологией биологических микрочипов при Институте молекулярной биологии им. В.А. Энгельгардта РАН. Центр будет предоставлять отечественную технологию биочипов сотрудникам РАН, а также и другим государственным и частным учреждениям.
ЛИТЕРАТУРА
1. Reviews: The Chipping Forecast // Nature Genetics. 1999. V. 21. P. 1-60.
2. Khrapko К., Lysov Yu., Khorlin A. et al. An oligonucleotide hybridization approach to DNA sequencing // FEBS Letters. 1989. V. 256. P. 118-122.
3. Arenkov P., Kukhtin A., Gemmell A. et al. Protein microchips: Use for immunoassay and enzymatic reactions // Anal. Biochem. 2000. V. 278. P. 123-131.
4. Gilbert W. DNA sequencing and gene structure // Science. 1981. V. 214. P. 1305-1312.
5. Лысов Ю., Флорентьев В., Хорлин А. и др. Определение нуклеотидной последовательности ДНК гибридизацией с олигонуклеотидами. Новый метод // Докл. Акад. наук СССР. 1988. Т. 303. С. 1508-151 1.
6. Барский В., Колчинский А., Лысов Ю., Мирзабеков А. Биологические микрочипы, содержащие иммобилизованные в гидрогеле нуклеиновые кислоты, белки и другие соединения: свойства и приложения в геномике // Мол. биол., 2002. Т. 36. С. 563-584.
7. Chechetkin V.R., Turygin A. Y., Proudnikov D. Y., Prokopenko D.V., Kirillov Eu.V. & Mirzabekov A.D. Sequencing by hybridization with the generic 6-mer oligonucleotide microarray: an advanced scheme for data processing // J. Biomol. Structure & Dynamics, 2000. V. 18. P. 83-101.
8. Vasiliskov V., Tirnofeev Е., Surzhikov S., Drobyshev A., Shick V., Mirzabekov A. Fabrication of microarray of gel-immobilized compounds on a chip by copolymerization // BioTechnique. 1999. V. 27. P. 592-606.
9. Barsky V., Perov A., Tokalov S. et al. Fluorescence data analysis on gel-based biochips // J. Biomol. Screening. 2002. V. 7. P. 247-257.
10. Proudnikov D., Kirillov Eu., Chumakov K. et al. Analysis of mutations in oral poliovirus vaccine by hybridization with generic oligonucleotide microchips // Biologicals. 2000. V. 28. P. 57-66.
11. Zasedateleva 0., Krylov A., Prokopenko D. et al. Specificity of mammalian Y-box binding protein p50 in interaction with ss and ds DNA analyzed with generic oligonucleotide microchip // J. Mol. Biol. 2002. V. 334. P. 73-87.
12. Guschin D., Mobarry B., Proudnikov D. et al. Oligonucleotide microchips as genosensors for determinative and environmental studies in microbiology // Applied and Environmental Microbiology. 1997. V. 63. P. 2397-2402.
13. Bavykin S.G., Akowski J.P., Zakhariev V.M., Barsky V.E., Mirzahekov A.D. Microbial identification: A portable system for sample preparation and oligonucleotide microarray hybridization // Appl. & Environ. Microbiology. 1997. V. 67. P. 922-928.
14. Nasedkina Т., Domer P., Zharinov V. et al. Identification of chromosomal translocation in leukemias by hybridization with oligonucleotide microarrays // Haematologica. 2002. V. 87. № 4.
15. LaForge K.S., Shick V., Spongier R. et al. Detection of single nucleotide polymorphisms of the human mu opioid eceptor gene by hybridization or single nucleotide extension // Am. J. Med. Genet., Neuropsyciatric Genetics Section, 2000. V. 96. № 5. P. 604-615.
16. Strizhkov B.N., Drobyshev A.L., Mikhailovich V.M., Mirzabekov A.D. PCR amplification on a microarray of gel-immobilized oligonucleotides: Detection of bacterial toxin- and drug-resistant genes and their mutations // BioTechniques. 2000. V. 29. P. 844-857.
17. Mikhailovich V., Lapa S., Gryadunov D. et al. Detection of rifampin-resistant Mycobacterium tuberculosis strains by hybridization and polymerase chain reaction on a specialized TB-microchip // Bull. Experim. Biol. & Medicine. 2001. V. 131. P. 94-98.
18. Mikhailovich V., Lapa S., Gryadunov D. et al. Identification of rifampin-resistant Mycobacterium tuberculosis strains by hybridization, PCR, and ligase detection reaction on oligonucleotide microchips // J. Clinical Microbiology. 2001. V. 39. P. 2531-2540.
19. Tillib S., Strizhkov B., Mirzabekov A. Integration of multiple PCR amplification and DNA mutation analyses by using oligonucleotide microchip // Analyt. Biochem. 2001. V. 292. P. 155-160.
20. Рубина А., Паньков С., Иванов С. и др. Белковые микрочипы // Докл. Акад. наук. 2001. № 5. С. 419-422.
21. Фесенко Д., Наседкина Т., Мирзабеков А. Бактериальный микрочип: принцип работы на примере обнаружения антибиотиков // Докл. Акад. наук, 2001. Т. 381. № 6. С. 831-833.
Июнь 2003