1997, том 67, № 11, с. 998-1013
| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
1997, том 67, № 11, с. 998-1013 |
ПЕРФТОРАН - ОН ЖЕ "ГОЛУБАЯ КРОВЬ"
|
Многим памятны острые научные дискуссии о возможности создания искусственного кровезаменителя на основе перфторуглеродов, в которые были вовлечены и средства массовой информации. Наш журнал также принял в них участие, опубликовав в 1989 г. утвержденное решением бюро Отделения биохимии, биофизики и химии физиологически активных соединений АН СССР заключение межведомственной комиссии, проанализировавшей состояние, перспективы создания и применения отечественных перфторуглеродных эмульсий. Комиссия отметила, что пока "в стране нет препаратов на основе перфторуглеродных эмульсий, предназначенных для практического использования как в качестве кровезаменителя - переносчика кислорода, так и в качестве перфузионной среды. Однако получение перфторуглеродных эмульсий для перфузии органов и тканей представляется весьма вероятным в ближайшем будущем" (Вестник АН СССР. 1989. № 6. С. 62). В 1990 г. в Институте теоретической и экспериментальной биофизики возобновились прерванные в 1985 г. работы над перфторуглеродным кровезаменителем. И 13 февраля 1996 г. было получено регистрационное удостоверение № 96/50/10 на газотранспортный перфторуглеродный кровезаменитель "Перфторан". Препарат разрешен для медицинского применения и промышленного выпуска в Российской Федерации. Этому крупному достижению отечественной науки посвящены две публикуемые ниже статьи, написанные создателями перфторана. От VIVOS VOCO! Драматическая история создания перфторана уже была освещена на наших страницах в очерке профессора С.Э. Шноля "Голубая кровь". Этот очерк напечатан в журнале "Знание-Сила" и вошел в качестве главы в книгу "Герои и злодеи российской науки". Cоздатели "голубой крови", однако, рекомендуют другие источники для более детального ознакомления с событиями тех, уже далеких лет. Особо любознательным читателям советуем прочесть материалы выездного заседания Президиума РАН (29.6.93), из которых они узнают условия, на которых РАН поддержала продолжение работы над "голубой кровью". |
Г.Р. Иваницкий, С.И. Воробьев
Авторы работают в Институте теоретической и экспериментальной биофизики РАН.
ИВАНИЦКИЙ Генрих Романович - член-корреспондент РАН, заведующий лабораторией.
ВОРОБЬЕВ Сергей Иванович - доктор биологических наук, старший научный сотрудник.Существуют три подхода к созданию кровезаменителей, обладающих газотранспортной функцией: на основе свободного модифицированного полигемоглобина [1 ]; гемоглобина, капсулированного в липидные везикулы - искусственного эритроцита [2 ]; перфторуглеродной (ПФУ) эмульсии [3 ]. Первые два, несмотря на большие усилия, вряд ли будут доведены до практического применения в текущем тысячелетии. Последний оказался более перспективным и привел к созданию безопасного и эффективного кровезаменителя - перфторана.
Разработка препарата была начата еще в 1979 г. по инициативе Ф.Ф. Белоярцева, И.Л. Кнунянца и Г.Р. Иваницкого [4 ]. В его создании на разных этапах принимали участие до 40 научных, научно-производственных и клинических учреждений. Перфторан был допущен к клиническому использованию лишь в 1996 г., после того как успешно прошел все стадии испытаний (первая и вторая фазы - в 1984 -1985 гг., более 600 пациентов; третья - в 1990-1995 гг., более 200 пациентов) и получил одобрение Фармакологического (22 декабря 1994 г.) и Фармакопейного комитетов (30 августа 1995 г.) Минздравмедпрома Российской Федерации.
Создание перфторуглеродных кровезаменителей оказалось более сложной проблемой, чем мы предполагали вначале. Необходимо было добиться выполнения ряда противоречивых условий: препарат не должен влиять на иммунную защиту организма, должен быть медицински безопасным, на его основе должна функционировать эффективная система газотранспорта.
ПУТИ ПРЕОДОЛЕНИЯ ИММУННОЙ ЗАЩИТЫ
Можно выделить три обобщенных функции крови, выполняемых совместно как молекулярными белковыми комплексами плазмы, так и форменными элементами крови:
транспортно-энергетическая - молекулярный массоперенос питательных веществ внутрь организма и отходов метаболизма к внешним фильтрующим органам, дыхание (транспорт O2 внутрь организма и CO2 наружу);
регуляторная - перенос гормонов (химических регуляторов) от органа к органу, стабилизация ионного баланса организма, терморегуляция (водное охлаждение);
защитная - коагуляция (свертывание) крови и репарация повреждений оболочек организма, иммунитет, то есть узнавание соединений "свой-чужой" и выведение из организма чужеродных включений.
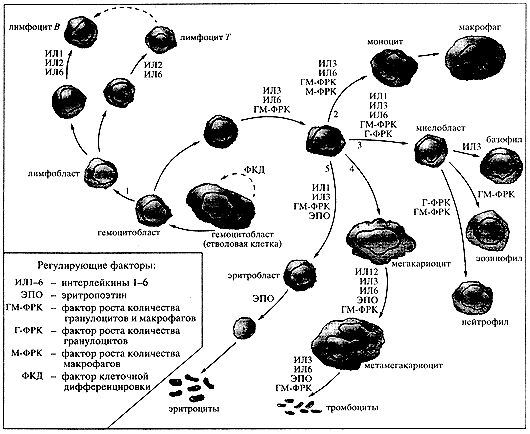
Третья функция крови затрудняет создание искусственных кровезаменителей, реализующих две первые функции. Иммунная система, основанная на кооперативном взаимодействии В и Т лимфоцитов (рис. 1), защищает организм наборами антигенов - антител, реагирует на опасные ситуации. Например, распознает бактерии, вирусы и другие чужеродные вещества в кровотоке и выбирает реакцию, в ходе которой они выводятся из организма (синтез лизирующих веществ, фагоцитоз). Можно достичь компромисса: сделать эффективную и безопасную смесь, моделирующую две первые функции крови, но не сильно возмущающую иммунную систему организма. В этом случае гемоглобин не обязательно должен быть материальной газотранспортной основой крови. А поскольку с помощью эволюционного отбора иммунная система настраивалась именно на отторжение чужеродных белковых включений, для кровезаменителей, моделирующих газотранспортные функции крови, следовало искать неорганические носители.
В 70-х годах после работ Л. Кларка, Р. Гетера, Р. Наито и других [5-7] идея "создать эффективный кровезаменитель на ПФУ" овладела многими исследовательскими группами во всем мире. Что представляют собой эти соединения?
Класс ПФУ-соединений практически бесконечен, как и многие органические соединения. Класс углеводородов переходит в класс ПФУ путем замещения в молекулах водорода на фтор. Перфторуглероды - слабо полярные соединения, в которых растворимость газов увеличивается по мере уменьшения полярности. Растворимость газов в чистых жидких ПФУ очень высокая - около 50 об. % O2 и 200 об. % CO2.
Перфторуглероды — химически инертные, так как покрыты "шубой" из фтора, ковалентно связанного с углеродом. Энергия связи C-F больше, чем энергии связи С-Н: для СН3-F она равна 119 ккал/мол, а для СН3-Н - 99 ккал/мол. Длина связи для фтора так же мала, как и для водорода (длина связи СН3-Н 1.09 А, СН3-F 1.39 А).Замещение водорода на фтор почти не изменяет объема молекулы, но делает ПФУ-соединение "жестким". Перфторуглероды не ингибируют деления лимфоидных клеток в культуральных системах и не продуцируют аберраций хромосом в делящихся клетках, они могут служить хорошим субстратом подложек для культивирования клеток [8 ].
Таблица 1
Компоненты Химические соединения (концентрация, %) Переносчики 02 Поверхностно-активное вещество
Низкомолекулярный раствор
ПФУ-декалин (13.0)*, ПФУ-метилциклогексилпиперидин (6.5) Проксанол 268 (4.0)
NaCI (0.6), KCI (0.039), MgCl2 (0.019), NaH2P04 (0.02), NaHC03 (0.65), глюкоза (0.2), CaCl2 (0.0003)
* Все величины вес./об. % указаны по отношению к 100% объема апирогенной дистиллированной воды.
ПФУ-соединения приблизительно в два раза тяжелее воды и в ней практически не растворяются, поэтому для целей кровезамещений необходимо приготовить эмульсию из перфторуглеродов. Для ее изготовления требуются поверхностно-активные вещества, в противном случае смесь будет плохо эмульгироваться и быстро расслаиваться.
В качестве эмульгаторов испробованы многие соединения (липиды животного и растительного происхождения, Д-сорбитолы, соли жирных кислот, аминооксиды, блок-сополимеры этиленоксида и пропиленоксида). Мы выбрали эмульгатор Плюроник F-68 (отечественное название - Проксанол-268; синтезирован в Научно-исследовательском институте органических полупродуктов и красителей). Если Плюроник F-68 хорошо очищен, он слаботоксичен и выводится из организма в течение нескольких часов.
Более того, это соединение, в отличие от других поверхностно-активных веществ, предотвращает гемолиз эритроцитов, создает незначительное коллоидно-осмотическое давление и является слабым антикоагулянтом. Понижая вязкость крови, оно одновременно усиливает эффективность ПФУ-эмульсии в условиях жировой эмболии в кровеносном русле. Плата за эти достоинства - термодинамическая неустойчивость эмульсии. Для длительного ее хранения необходима заморозка.
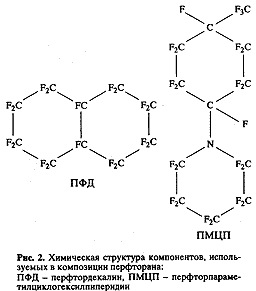
Анализ многочисленных ПФУ-соединений с позиций медицинской практики свидетельствует, что ни одно из них в полной мере не отвечает оптимальности в системе параметров "эффективность + безопасност ь". Поэтому и родилась идея создания их бинарных смесей, в которых достоинства и недостатки двух разных видов ПФУ-компонентов компенсируются. Эта идея принадлежала группе Р. Наито и была ими реализована в кровезаменителе Флюозол-ДА (разрешение Food and Drug Administration на клиническое использование датируется январем 1990 г.). Однако, как показали наши исследования, характеристики этого препарата можно улучшить, заменив один из двух ПФУ-компонентов. Мы заменили перфтортрипропиламин на перфтор-пара-метилциклогексил-пиперидин (рис. 2). Для этого пришлось подобрать соответствующее поверхностно-активное вещество и композиционный состав эмульсии (табл. 1). Токсичность препарата снизилась на 15%, эффективность по кислородному транспорту возросла в 1.5 раза. При этом время выведения препарата из организма (как плата за эти преимущества) увеличилось на 25-30%. Кроме того, удалось уменьшить его реактогенность - ответ иммунной системы на введение препарата.
Как известно, все медицинские препараты в виде микрочастиц в той или иной степени реактогенны, то есть вызывают у некоторых пациентов боль в крестце, озноб, покраснение кожи, одышку. Подобный синдром иногда наблюдается и при внутривенном введении жировых эмульсий без перфторуглерода, применяемых для парентерального питания, и липосом, используемых для направленной доставки лекарств, а также при кровопотерях во время хирургических операций. Эти симптомы могут быть блокированы такими препаратами, как индометацин, дексаметазон или ибупрофен, другими словами, десенсибилизирующими и седативными препаратами в комплексе с кортикостероидными средствами [3-9 ].
При введении чужеродных микрочастиц в организм в системе синтеза форменных элементов крови должен стимулироваться процесс дифференцировки стволовой клетки по путям лимфоцитов и макрофагов (см. рис. 1). Кровь - реактивная субстанция и скорость обновления форменных элементов сравнительно высокая: в минуту синтезируется 15х107 эритроцитов, 2х105 лейкоцитов, 2.5 х 103 тромбоцитов. Тем не менее относительное изменение форменных элементов во времени сравнительно медленное: лимфоциты человека обновляются за 8-10 часов, тромбоциты - за 4 суток, другие лейкоциты -за 5 дней, эритроциты за 110-120 дней. Однако реакция (если она возникает) на введение микрочастиц в кровяное русло почти мгновенная - латентный период не превышает минуты. Следовательно, ответ иммунной системы имеет триггерный (спусковой) или лавинообразный механизм.
Скорее всего, действие этого механизма обусловлено не процессами дифференцировки на клеточном уровне, а триггерным высвобождением арахидоновой кислоты во время фагоцитирования микрочастиц макрофагами [3 ]. Возможен альтернативный вариант: активация поверхностно-активными веществами системы комплемента плазмы крови и высвобождением так называемых стресс-белков. Последние способствуют, с одной стороны, фагоцитированию микрочастиц, а с другой - возникновению предпосылок к анафилактоидному шоку в связи с появлением анафилотоксинов [3 ]. Кроме того, сам процесс прокола вены и введения препарата мог вызвать стрессовую реакцию. Эти варианты не противоречили друг другу, являясь последовательными звеньями одной цепи событий на молекулярном и клеточном уровнях. На клеточном наблюдалось не только временное (медленное) изменение формулы крови, но и пространственное (быстрое) перераспределение форменных элементов по системам кровотока организма, а также нарушения в белковой фракции крови. Отсюда следует, что индексом реактогенности препарата могут служить Различные количественные показатели на молекулярном и клеточном уровне, так как они коррелированы.
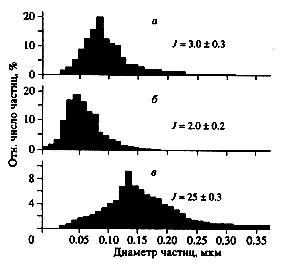
В качестве такового мы взяли нейтропенический индекс J = Сц/Сп, где Сц и Сп соответственно количество нейтрофилов (см. рис. 1) в периферическом кровотоке после трансфузии препарата, содержащего микрочастицы, и в норме. Такой индекс информативен и отражает сдвиги как в белковой фракции, связанные с белковыми продуктами активации комплемента в плазме крови, так и в развитии последующих событий в цепи переходов вплоть до клеточного уровня дифференцировки [9 ]. Нейтропенический индекс характеризует быстрое пространственное перемещение нейтрофилов из периферического русла и скопление их в сосудах легких. Экспериментальным путем установлено, что максимальное его значение не должно превышать 2-3 [10 ], в противном случае эмульсия реактогенна.
Наши исследования показали, что отдельно взятый 4%-н ый раствор поверхностно-активного вещества проксанола не обладает реактогенными свойстами, вопреки распространенному мнению. Было установлено, что по мере роста диаметра частиц и доли крупных частиц в эмульсии усиливается имунная реакция и увеличивается значение нейтропенического индекса. Эти исследования позволили заложить в технологию перфторана соответствующие требования к размерам и дисперсии микрочастиц эмульсии, обеспечивающие снижение реактогенности препарата (рис. 3). Так было выполнено первое условие - сделать препарат незаметным для иммунной системы организма, то есть нереактогенным.
Перфторуглероды демонстрируют биологическую активность на молекулярном уровне, взаимодействуя с клеточными мембранами и рецепторами, растворяясь в липидах. Поверхностное натяжение перфторуглеродов в большинстве случаев не поднимается выше 20 мН/м (20 дин/см). У жидких ПФУ оно обычно 10-20 мН/м, что указывает на чрезвычайно низкую величину их межмолекулярных взаимодействий. (Напомним, что поверхностное натяжение воды 72 дин/см при 20°С.) Жидкости с поверхностным натяжением выше 20 мН/м не смачивают поверхность перфторуглеродов, а жидкие ПФУ не смешиваются с ними. Однако многие масла и н-гептан имеют поверхностное натяжение меньше 20 дин/см и жидкие ПФУ растворяются в них. Поэтому гидрофобно-липофильный индекс, то есть растворимость в воде и в н-гептане, - важный показатель перфторуглеродов, характеризующий как скорость их выведения из организма, так и взаимодействие с мембранами и рецепторами клеток. Следует учитывать, что это индекс температурозависимый.
ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ БЕЗОПАСНОСТИ
Другими важными показателями перфторуглеродов являются давление паров и температура кипения, характеризующие скорость выведения этих веществ из организма. Период полувыведения перфторуглеродов, перспективных с точки зрения медицины, колеблется от четырех дней до нескольких месяцев.Чем ниже точка кипения и выше давление паров, тем быстрее они выводятся через легкие. Однако существуют многие альтернативные пути выведения, и не только в виде выдыхаемых паров. Кроме того, стремление (в погоне за скоростью выведения) использовать перфторуглероды с низкой температурой кипения и большим давлением паров может привести к нежелательным физиологическим эффектам (к эмболии легких и декомпрессионным синдромам - кожному зуду, опуханию тканей).
В процессе доклинических исследований была показана безопасность препарата перфторан. Токсичность его низкая: летальная доза на мышах (при внутривенной инъекции) 200 мл/кг без плазмозаменителя и 140 мл/кг в полной композиции. Перфторан не вызывал гемолитических эффектов на крысах, собаках и в крови человека, не был пирогенным, не вызывал анфилактоидных реакций и не ингибировал синтез крови организмом. Доклинические исследования включали изучение взаимодействия перфторана с биологическими молекулами и органоидами, его воздействия на ионный транспорт через мембраны клеток, влияния на функционирование отдельных органов (сердце, почки, мозг) крыс и собак при перфузии через них препарата, а также определение предельной токсичности препарата при массивных кровезамещениях (до 70-90% объема крови). Доза 20 мл/кг перфторана не тератогенна, не эмбриотоксична, не канцерогенна и не вызывает патологических изменений в органах животных [11, 12 ].
В 1992 г. независимые эксперты Фармацевтической корпорации "Альянс" (США) своими методами исследовали препарат перфторан. Были проверены все его параметры и дополнительно изучены пульмонологические эффекты, выраженность тромбоцитопении и кинетика изменения температуры тела крыс после введения препарата в условиях свободного поведения животных. После биологического тестирования перфторана вице-президент фирмы "Альянс" доктор С. Файтфул прислал нам результаты анализа с резюме: "It would seem that you have a very good emulsion".
Таким образом, было выполнено второе условие - достигнута медицинская безопасность препарата.
Кровь - сильно структурированная, неньютоновская жидкость, текущая в пульсирующем режиме по сосудам - эластичным трубкам переменного сечения. В такой системе могут возникать нелинейные кооперативные явления как на макроуровне (при переходе от одного диаметра сечения сосудов к другому), так и на микроуровне (в пределах одного сечения, за счет взаимодействия форменных элементов крови и белков плазмы). Основные структурные факторы, определяющие гидродинамику крови, приведены на рис. 4 [13 ].
СОЗДАНИЕ ЭФФЕКТИВНОЙ СИСТЕМЫ ГАЗОТРАНСПОРТА

Реология крови является существенным параметром гидродинамики кровотока, сильно влияющим на вязкость, а следовательно, определяющим как нагрузку на сердце, так и скорость кровотока. Вязкость крови может изменяться в десятки раз при развале структур эритроцитов типа "монетных столбиков", изменения их упругих и ориентационных свойств, а также при нарушении белкового состава крови (рис. 5).
Чтобы вся система организма была бы "прозрачной" для распространения кислорода, необходимо согласовать кислородное напряжение в каждом локальном объеме со скоростью его диффузии в ткань: по мере падения кислородного напряжения должно уменьшаться сопротивление его потоку. Тогда поток (транспорт) кислорода оставался бы достаточным для обеспечения любого органа даже в условиях его интенсивной работы. В артериях у человека и других животных кислородное напряжение составляет 80-95 мм рт. ст., в капиллярах снижается на 20-45 мм рт. ст., около митохондрий внутри клеток ткани составляет всего 1-3 мм рт. ст. [14 ].
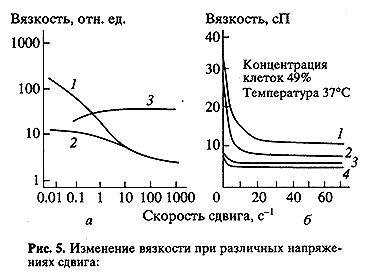
а - относительное изменение вязкости трех видов эритроцитарных суспензий: 1 - нормальные эритроциты в плазме крови (эритроциты при этом движутся в виде "монетных столбиков", обтекаемых плазматическими белками); 2 - нормальные эритроциты в растворе Рингера-Альбумина (эритроциты при этом не обнаруживают тенденции к упорядочению в виде "столбиков"), 3 - эритроциты, обработанные глутаральдегидом, который меняет структуру мембран эритроцитов, делая ее более жесткой, в этом же растворе Рингера-Альбумина; б - изменение вязкости суспензии эритроцитов как функция скорости сдвига при изменении содержания различных белков: 1 -глобулин 2.2 вес. %, 2 - цельная кровь, 3 - альбумин 3.5 вес. %, 4 - фибриноген 0.6 вес. %Возможны три варианта уменьшения сопротивления потоку кислорода в ткань, компенсирующие падение его напряжения: увеличение поверхности обмена, изменение скорости потока крови с помощью раскрытия капилляров или уменьшения вязкости крови, и наконец, увеличение проводимости кислорода плазмой от эритроцита в ткань.
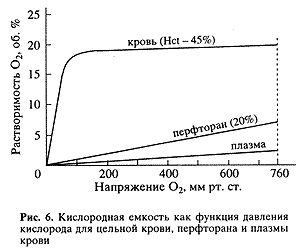
Кислородная емкость ПФУ-эмульсий по сравнению с цельной кровью сравнительно низкая (рис. 6). Кровь с 45%-ным содержанием гематокрита (отношение объема всех форменных элементов крови к объему плазмы в процентах) растворяет при кислородном давлении, равном 100 мм рт. ст., около 20 об. % O2, а 20%-ная ПФУ-эмульсия - около 2-2.5 об. % O2. Тем не менее емкость этой эмульсии по отношению к кислороду в 2-3 раза больше, чем у плазмы крови и воды. Однако она явно недостаточна для поддержания клеточного метаболизма тканей. Кроме того, кислородное насыщение гемоглобина имеет S-образную характеристику, а насыщение ПФУ-эмульсии кислородом - линейную. Хотя мнение, что гемоглобин в силу химического связывания обладает высокой кислородной емкостью, преувеличено, 1 г гемоглобина может присоединить максимум 1.38 мл O2, а, например, 1 г железа (если образуется закисное железо) присоединяет 300 мл O2 [14].
Коэффициент полезного действия транспортировки O2 с помощью гемоглобина низкий. Тяжелая молекула гемоглобина весом около 70 кДа "перевозит" за цикл кровотока всего четыре молекулы O2 весом 128 Да, что составляет по весу от транспортирующей молекулы всего 0.2%. Проявив большую расточительность в транспортирующей системе, природа выиграла за счет кооперативных эффектов в системе регуляции (загрузки и разгрузки кислорода).
Гемоглобин нагружается и расстается со своим кислородным наполнением в узком диапазоне изменений давлений газа в среде (от 0 до 100 мм рт. ст.). Скорость загрузки-разгрузки зависит от рН среды (эффект Бора): при рН 7.26 время перехода от гемоглобина к оксигемоглобину составляет 40-80 мс, а при рН 7.24 - уже 300 мс. Кислородная емкость 1 л крови такая же, как 1 л воздуха, то есть благодаря гемоглобину внутренние органы имеют потенциальную возможность (если она реализуется) получить столько же кислорода, сколько и наружные.
Низкая кислородная емкость ПФУ-эмульсии почему-то дала основание к умозрительному утверждению, что они неэффективны для кислородного транспорта. Приведем типичное высказывание, которое в разных вариантах повторялось в 80-х годах в литературе:
"О неэффективности в настоящее время использования эмульсий ПФОС первого поколения в качестве кровезаменителя - переносчика кислорода свидетельствуют, например, данные Tremper et аl. (1984), которыми показано, что при клиническом применении 20% вес./об. эмульсии "Флюозола-DA" в дозе 20 мл/кг флюорокрит составляет приблизительно 3%, что соответствует 0.5% гемоглобина. Трудно представить, что дополнительные 0.5% гемоглобина смогли бы значительно повлиять на кислородный и гемодинамический статус больного" [15 ].
Как следствие этого утверждения, некоторые исследователи увеличивали содержание ПФУ-частиц в кровотоке, повышая концентрацию эмульсий. При этом эффект получался обратный ожидаемому - транспорт кислорода в ткань уменьшался. Утверждение о неэффективности ПФУ-эмульсии, по нашему мнению, основано на недоразумении, связанном с подменой понятия "кислородный транспорт" на "кислородную емкость".
Кислородный , транспорт - это диффузионный поток кислорода в ткань. Кислородный поток i никак не связан с кислородной емкостью, а определяется в соответствии с законом Фика только величиной коэффициента диффузии кислорода D и разностью кислородных потенциалов между кровью и тканью (U01 - U02):
i = D(U01 - U02).
Закон Фика аналогичен закону Ома, поэтому поясним приведенное выше утверждение элементарной моделью из электрических цепей. Допустим, у нас есть небольшой электромоторчик и электрическая батарейка. Присоединим мотор чик с помощью медного провода к батарейке. Очевидно, величина тока, текущего по цепи, будет определяться напряжением на клеммах батарейки и проводимостью цепи (величиной обратной внутреннему сопротивлению батарейки + сопротивление провода + сопротивление обмоток моторчика).
От емкости батарейки зависит не величина тока, а продожительность работы двигателя. Если мы по мере уменьшения зарада на батарейке будем заменять ее новой, то моторчик сможет совершать работу сколь угодно долго. Теперь соединим моторчик с батарейкой не медным проводом, а, например, стеклянным волокном. При этом все напряжение упадет на волокне, так как проводимость стекла низкая, и моторчик не будет совершать работу, независимо от емкости батарейки, включенной в цепь.
Эта модель имеет очевидные соответствия с реальной системой газотранспорта в организме: батарейка - с эритроцитом, моторчик - с митохондриями клеток ткани, скорость замены батареек - со скоростью или минутным объемом кровотока, величина разряда батарейки определяется артериально-венозной (А - В) разностью кислородной емкости в системе "эритроциты + плазма крови".
Соединительные провода высокой проводимости (медь в нашем примере) аналогичны непосредственному контакту мембраны эритроцита со стенкой артериол и капиллярных сосудов, а провода низкой проводимости (стекло в нашем примере) - передаче кислорода через плазму крови (воду). Последняя ситуация типична при восполнении кровопотери традиционными кровезаменителями без газотранспортной функции (растворы Рингера и Тироде, полиглюкин, желатиноль, лактосол, плазма крови и т.д.), но абсолютно отлична при кровезамещении ПФУ-эмульсией.
Проводимость кислорода чистыми перфторуглеродными эмульсиями по сравнению с водой очень высокая. Растворимость кислорода в ПФУ-эмульсиях до 50 об. % а в воде - только 2%, то есть в 25 раз меньше.Таким образом, если возникает цепь из касающихся друг друга частичек ПФУ-эмульсии, то проводимость кислорода возрастает и соответственно увеличивается ток O2 от эритроцита как источника с высоким парциальным давлением кислорода в ткань (рис. 7, а).
..
Эритроциты, экранируемые водой, никогда не отдают полностью свой кислородный заряд. Артериально-венозная разность кислородной емкости даже при больших физических нагрузках не увеличивается более чем на 30%. Таким образом, 20-30% эритроцитов, если бы они полностью отдали свой кислородный заряд в ткань при (А - В) —> А, хватило бы для нормального функционирования организма. Однако этого не только не происходит, а наоборот, при развале структур эритроцитов типа "монетных столбиков" увеличивается экранировка эритроцитов водой и отдача кислорода ухудшается. Венозная кислородная емкость растет, а не падает. Кислород растворяется в плазме, но не переходит в ткань. Как правильно отметил С.В. Ярочкин, "наступает гипоксия при гипероксии": емкость кислорода в плазме большая, но кислородное напряжение незначительное и ток кислорода в ткань низкий [16 ].Нами показано, что вероятность образования цепей-каналов из ПФУ-микрочастиц в плазме крови пропорциональна nr/r2m, где n, r, r - соответственно скорость кровотока, плотность и радиус микрочастиц эмульсии, m - статическая вязкость, пропорциональная rC2/a, где С - концентрация частиц в кровотоке, a - коэффициент диффузионной подвижности частиц в воде. Отсюда ясно, что чрезмерное повышение концентрации ПФУ-частиц в кровотоке увеличивает вязкость крови после замещения, снижает диффузионную подвижность самих частиц в воде и не улучшает, а ухудшает газотранспорт [17 ].
При кровезамещениях ПФУ-эмульсиями нецелесообразно (и даже вредно) превышать оптимальную их концентрацию в кровотоке. Существенным показателем качества эмульсий является не абсолютная кислородная емкость, а динамическая емкость, равная частному от деления абсолютной емкости на вязкость. У перфторана вязкость низкая, меньше 3.0 сП (табл. 2). Нами проведено сравнение ПФУ-эмульси и, созданных разными зарубежными исследовательскими группами, по этому критерию [18 ].
Очевидно, что размеры и дисперсия размеров частиц также играют существенную роль в частоте образования каналов. Их проводимость определяется площадью поверхности контактирующих частиц. Относительные размеры частицы и эритроцита показаны на рис. 7, б. Соотношение их поверхности при равенстве суммарных объемов равно 6 х 103. Таким образом, движущиеся в кровотоке частицы могут создавать одновременно колоссальное количество каналов, замыкая поверхность эритроцитов на стенки сосудов.Один из экспериментальных результатов с митохондриями печени крысы, демонстрирующий эффективность ПФУ-эмульсий при кровезамещениях, представлен на рис. 8. Величина потока O2 определялась по изменению скорости окисления различных субстратов митохондрий. Скорость окисления, в свою очередь, измерялась полярографически с помощью Кларковского электрода.
В другом эксперименте у кроликов с имплантированными электродами регистрировали кислородное напряжение в мозговой ткани при инфузии шести типов ПФУ-эмульсий. Как и следовало ожидать, увеличение O2 в ткани мозга не соответствовало низкому суммарному уровню кислородной емкости плазмы в кровяном русле и показателям растворимости O2 в ПФУ-эмульсий. Дело в том, что существенный дополнительный вклад вносил кислород, передаваемый в ткань от эритроцитов по каналам, образуемым движущимися в кровотоке частицами ПФУ-эмульсий. Результаты клинического применения перфторана изложены в [19 ].В широком спектре использования искусственных кровезаменителей, как и донорской крови, можно выделить главные области, например, сердечная недостаточность, сердечный приступ, инсульт и геморрагический шок, но на первом месте по их потреблению стоит хирургическое вмешательство. Однако при переливании донорской крови необходима тщательная ее проверка на возможное наличие многочисленных возбудителей патологий, которые могут быть переданы реципиенту (табл. 3). Эта процедура сильно удорожает стоимость донорской крови, приближая ее к стоимости искусственного заменителя, где опасность заражения полностью отсутствует.
Таблица 3.
Хронология открытий возбудителей патологий, содержащихся в крови,
и создания методов контроля за качеством донорской крови [20]
Год Открытие, метод контроля Патология 1945 Метод контроля бледной трепонемы (1905) Сифилис 1971 Техника обнаружения антиге на вируса гепатита В (1964) на основе поверхностного антигена Гепатит 1983 Открытие вируса человеческого иммунодефицита (HIV) СПИД 1985 Метод иммуннодепрессии цитомегаловируса (1956) Цитомегаловирусная
инфекция1985 Метод контроля вируса VCH-1 (1956) на основе антител СПИД 1985 Поэтапное индустриальное производство тестов обнаружения антител анти-HIV I, подавление вирусов путем тепловой фракционной коагуляции СПИД 1986 Детальное описание поражения эритроцита мерозоитами (1969), выявление возбудителей методами плазмодиализа Лихорадка (малярия) 1987 Техника обнаружения разных, типов вирусов; разработка растворителей-очистителей, коагулирующих вирусные частицы СПИД, гепатит, другие скрытые вирусы 1988 Методика эпидемиологического изучения вирусных гепатитов у предполагаемых доноров, включающая оценку частоты появления вирусов и методы профилактики Гепатит - новый вид 1989 Техника определения возбудителей СПИДа путем идентификации
смешанных форм HALVE 1 и 2СПИД 1990 Идентификация генома вируса гепатита С (1988), тесты второго поколения его диагностики на основе антител Гепатит С 1991 Получение структурных протеинов вируса HCV и использование их для обнаружения антителами; технология второго поколения Гепатиты 1991 Определение факторов риска, заноса инфекции с донорской кровью, связанных с ретровирусами, вирусами СПИДа и гепатита, создание систематики антител СПИД, гепатит другие скрытые вирусы
Прогнозы дальнейшего развития перфторуглеродных кровезаменителей - дело неблагодарное, ибо новые открытия спланировать нельзя. Тем не менее на основе накопленного нами за 15 лет опыта можно попытаться сделать прогнозы на качественном уровне. При создании следующих поколений кровезаменителей возможны три сценария:• удастся синтезировать какое-либо одно ПФУ-соединение, которое окажется идеальным по всем параметрам как основа кровезаменителя; вероятность такого исхода очень мала;
• показатели перфторана как бинарной композиции превзойти не удастся; вероятность такого сценария хотя и выше предыдущего, но тоже невелика;
• удастся создать новые композиции из двух и более различных перфторуглеродов, причем недостатки одних перекроются достоинствами других; это наиболее вероятный сценарий.
Авторы благодарят Российскую академию наук, Российскую академию медицинских наук, многочисленных сотрудников клиничесих учреждений Минздрава РФ и Центрального военно-медицинского управления Министерства обороны РФ и всех исполнителей программы "Перфторуглероды в биологии и медицине". Мы также благодарны Российскому фонду фундаментальных исследований (грант 96-04-4812) и всем, кто спонсировал на различных этапах эту работу.
ЛИТЕРАТУРА
1. Blood substitutes // Eds. Chang T.M.S., Geyer R.P. N.Y.: Dakker, 1989.
2. Blood substitutes: Preparation, Physiology and Medical Applications / Eds. Lowe K.C. Chichester: Ellis Horwood. 1988.
3. Riess J.G. Fluorocarbon-based in vivo Oxygen Transport and Delivery Systems / Vox Sang; Invited Review. 1991. V. 14. P. 225-239.
4. Иваницкий Г.Р., Белоярцев Ф.Ф. О развитии фундаментальных и прикладных исследований в СССР по проблеме "Перфторуглероды в биологии и медицине" // Медико-биологические аспекты применения эмульсий перфторуглеродов. Пущине: ОНТИ НЦБИ АН СССР, 1983. С. 7-38
5. Сlark L., Gollan F. Survival of mammals breathing organic liquids equilibrated with oxigen at atmospheric pressure // Science. 1966. V. 152. P. 1755-1756.
6. Geyer R.P. Fluorocarbon polyol arificial blood substitutes // New Engl. J. Med. 1973. V. 289. P. 1077-1082.
7. Naito R., Yokoyama K. On the perfluorodecalin/phospholipid emulsion as the red cell substitute // Proc. X-th Int. Congr. Nutz-Symp. PFC Artif. Blood. Kyoto. 1975. P. 55-72.
8. Иваницкий Г.Р., Архипов В.В., Белоярцев Ф.Ф, Лежнев Э.И. Культивирование животных клеток на жидких перфторуглеродах // ДАН. 1981. Т. 28. № 1. С. 225-228.
9. Пятковская Н.Н., Седова Л.А., Беркос М.В., Кочетыгов Н.И. Сравнительная оценка реактогенности эмульсии перфукола и перфторана // Перфторуглеродные активные среды для медицины и биологии (новые аспекты исследования) / Ред. Иваницкий Г.Р., Воробьев С.И. Пущино, 1993. С. 167-173.
10. Воробьев С.И., Кутышенко В.П., Склифас А.Н. и др. Комплементактивирующее действие перфторуглеродных эмульсий // Биосовместимость. 1995. Т. 3. № 1-2. С. 51 -62.
11. Кокоз Ю.М., Кобринский Е.М., Фрейдин Е.М. и др. Действие газопереносящей эмульсии перфторуглеродов на миокард (ионный транспорт, сократительная активность и чувствительность к медиаторам) // ДАН. 1983. Т. 270. № 2. С. 459-462.
12. Воробьев С.И., Иваницкий Г.Р., Ладилов Ю.В. и др. Модификация мембран клеток перфторуглеродами как возможный механизм уменьшения степени ишемического повреждения миокарда // ДАН. 1988. Т. 299. № 2. С. 228-230.
13. Каро К., Педли Т., Шротер P., Сид У. Механика кровообращения. М.: Мир, 1981.
14. Иванов К.П. Современные проблемы дыхательной функции крови и газообмена в легких // Физиол. журнал им. Сеченова. 1992. Т. 78. № 11. C. 11-26.
15. Вестник АН. 1989. № 6. С. 61.
16. Ярочкин B.C. Гипоксия при гипероксии // Физиологическая активность фторсодержащих соединений (эксперимент и клиника) / Ред. Иваницкий Г.Р., Воробьев С.И. Пущино, 1993. С. 107-114.
17. Иваницкий Г.Р., Воробьев С.И. Образование подвижных структур в кровотоке - основа функционирования перфторуглеродной "искусственной крови" // Биофизика. 1996. Т. 41. № 1. С. 178-190.
18. Иваницкий Г.Р., Воробьев С.И., Макаров К.П., Архипов В.В. Сравнительное изучение перфторуглеродных эмульсий // Физиологическая активность фторсодержащих соединений (эксперимент и клиника) / Ред. Иваницкий Г.Р., Воробьев С.И. Пущино, 1995. С. 33-41.
19. Мороз В.В., Крылов Л.Н., Иваницкий Г.Р. и др. Применение перфторана в клинической медицине // Анестезиол. и реаниматол. 1995. № 6. С. 12-17.
20. Le sang / La Recherche special. 1993. Mai. V. 24. № 254.
Март 1999