| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
том 73, № 12, с. 1085-1097 (2003) |
| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
том 73, № 12, с. 1085-1097 (2003) |
© П.Л. Иванов
ИНДИВИДУАЛИЗАЦИЯ ЧЕЛОВЕКА И ИДЕНТИФИКАЦИЯ ЛИЧНОСТИ:
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ В СУДЕБНОЙ ЭКСПЕРТИЗЕ
П. Л. Иванов
Иванов Павел Леонидович - д.б.н., в.н.с. Института
молекулярной биологии им. В.А. Энгельгардта РАН,
зав.отд. Российского центра судебно-медицинской экспертизы
Минздрава РФ.
История судебных наук, в частности, криминалистики и тесно с нею связанной судебной медицины, насчитывает более века. Примерно столько же времени прошло и с момента открытия в ядрах клеток вещества, названного нуклеином. Это открытие положило начало другому научному направлению - изучению ДНК, или дезоксирибонуклеиновой кислоты. Вплоть до середины 80-х годов прошлого века эти области знания, а именно: научные исследования в сфере криминалистики и изучение того, каким образом хранится и реализуется записанная в молекуле ДНК наследственная информация, никак не пересекались. Их историческая взаимосвязь впервые обозначилась в 1985 г., когда в июльском номере журнала "Nature" появилась статья профессора Лестерского университета в Англии А. Джеффриса «Индивидуально-специфичные "отпечатки пальцев" ДНК человека» [1]. В декабре того же года А. Джеффрис и П. Гилл из Алдермастонского экспертно-криминалистического центра МВД Великобритании опубликовали еще одну статью под названием “Судебно-экспертное использование "отпечатков пальцев" ДНК” [2]. В этих ключевых работах впервые была продемонстрирована возможность использования анализа хромосомной ДНК человека для судебно-экспертной идентификации личности. Так родилась геномная "дактилоскопия" - метод, который признан одним из самых выдающихся достижений XX столетия в области судебных наук.
В нашей стране исследования по геномной дактилоскопии были начаты при непосредственном участии автора этих строк в 1987 г. в Институте молекулярной биологии им. В.А. Энгельгардта АН СССР, в лаборатории академика Г.П. Георгиева. Здесь в группе, руководимой доктором биологических наук А.П. Рысковым, был получен целый ряд приоритетных результатов и разработан первый отечественный метод мультилокусного типирования ДНК [3-5].
В декабре 1988 г. на базе Института молекулярной биологии им. В.А. Энгельгардта РАН и Бюро Главной судебно-медицинской экспертизы Минздрава России автором этих строк была проведена первая в нашей стране молекулярно-генетическая идентификационная экспертиза, позволившая изобличить особо опасного убийцу-маньяка. Эта экспертиза и положила начало внедрению методов геномной дактилоскопии в практику работы правоохранительных органов России [6, 7]. Тогда же под эгидой Института молекулярной биологии РАН при Бюро Главной судебно-медицинской экспертизы была организована первая в СССР экспертная лаборатория молекулярно-генетической идентификации (ныне Отдел молекулярно-генетических научных и экспертных исследований Российского центра судебно-медицинской экспертизы Минздрава России). Лаборатория была призвана освоить новейшие методы анализа биологических следов как объектов судебно-медицинской экспертизы с использованием технологии молекулярно-генетической индивидуализации человека. Ее успешная деятельность подтвердила необходимость активного внедрения молекулярно-генетических методов в практику судебно-медицинской службы России.
ГЕНОТИПИРОВАНИЕ КАК ВИД СУДЕБНО-МЕДИЦИНСКОЙ ЭКСПЕРТИЗЫ
Молекулярно-генетический идентификационный анализ, традиционно называемый геномной (генетической) "дактилоскопией", или генотипированием (в англоязычной литературе - DNA profiling, DNA fingerprinting или DNA typing), по своей сути направлен на выявление индивидуальных особенностей, так сказать, "особых примет" генетической конституции конкретного человека. Этот подход не имеет аналогов среди использовавшихся ранее методов судебно-экспертной идентификации личности, хотя само его название частично заимствовано из классической судебной науки.
Как известно, дактилоскопия - термин из криминалистики и обозначает метод идентификации личности, основанный на изучении и сравнительном анализе кожных узоров ладонных поверхностей ногтевых фаланг пальцев рук. В названии "геномная или генетическая дактилоскопия" термин дактилоскопия используется иносказательно. На самом деле речь идет о принципиально иной технологии установления личности, основанной не на изучении отпечатков пальцев, а на анализе клеточной ДНК - универсального носителя наследственной информации.
Каждый человек, как и любой живой организм, имеет свой характеристический фенотип (то есть набор внешних и внутренних признаков и свойств), отличающий его от других ему подобных организмов. Отличия обусловлены уникальностью любого индивидуального генотипа - всего набора генов данного организма. (Единственным исключением из этого правила можно считать монозиготных близнецов.) Генетический же материал, заключенный в разных клетках и тканях одного индивидуума, в норме одинаков. Итак, два основополагающих принципа - индивидуальная генетическая уникальность каждого организма и генетическая идентичность всех его клеток и тканей — составляют концептуальную основу молекулярно-генетической индивидуализации.
Ключевой смысл анализа - выявление индивидуальных генетических различий или генетического сходства биологических объектов и, как следствие, установление их отличия или тождества либо их генетического родства. На ранних этапах развития метода конечный этап всей сложной многостадийной процедуры сводился к анализу специфических графических изображений, условно говоря, "отпечатков пальцев" наследственного материала человека. При этом основой для экспертного заключения чаще всего служило отображение индивидуальных характеристик ДНК в виде графического образа, а именно: специфического набора линий, отдаленно напоминающего картинку так называемого бар-кода (рис. 1). Отсюда, по аналогии с анализом дактилоскопического оттиска, возникло название - генетическая, или точнее, геномная "дактилоскопия". Термин введен в 1985 г. Джеффрисом (в английском оригинале - DNA Fingerprinting, буквально - "снятие отпечатков пальцев ДНК"). В настоящее время его надо рассматривать как устаревший, поскольку в научной лексике он вытеснен более строгими определениями, например, типирование ДНК или генетическая идентификация.

Рис. 1. "Геномный оттиск" ДНК человека
В качестве гибридизационной пробы для анализа рестриктазного гидролизата
суммарной геномной ДНК человека
использовался радиоактивно меченный молекулярный зонд 33.15 ДжеффрисаМолекулярно-генетический идентификационный анализ позволяет исследовать особые участки ДНК, строго специфичные для каждого индивидуума, и получить таким образом уникальный генетический "паспорт" или "удостоверение личности" человека, которое нельзя ни скрыть, ни изменить, ни подделать. Индивидуализирующие признаки, определяемые на уровне ДНК, характеризуются почти абсолютной устойчивостью, то есть сохраняются в организме человека неизменными всю его жизнь и неизменными отображаются в его биологических следах. Поэтому идентификационная значимость генетических признаков чрезвычайно высока.
Типирование ДНК ныне стало наиболее доказательным методом анализа биологического материала при производстве судебно-медицинской идентификационной экспертизы. Эти технологии прочно вошли в арсенал экспертной деятельности судебно-медицинских служб большинства развитых стран мира: Австралии, Австрии, Великобритании, Германии, Италии, Испании, Канады, России, США, Франции, Швейцарии, Японии. Более чем 15-летний опыт внедрения молекулярно-генетических методов в практику работы правоохранительных органов убедительно свидетельствует о том, что эффективность расследования многих тяжких преступлений против личности может быть существенно повышена. Применительно к задачам судебно-медицинской экспертизы генетические методы особенно эффективны в двух случаях: идентификации личности и установления биологического родства.
В первую очередь, речь идет об идентификации личности при расследовании убийств, тяжких телесных повреждений, изнасилований и других преступлений, требующих судебно-медицинского исследования вещественных доказательств, а также при опознании расчлененных или сильно разрушенных трупов, например, в случаях массовых природных и техногенных катастроф и военных конфликтов. Однако геномная "дактилоскопия", в отличие от традиционной криминалистической дактилоскопии, позволяет не только однозначно устанавливать личность, но и определять кровное родство лиц. Это делает ее незаменимым экспертным методом в сложных случаях подмены, утери, похищения детей, определения родства малолетних или потерявших память лиц, выявления фактов кровосмешения. Метод также весьма эффективно используется и в решении гражданских дел - установлении отцовства или материнства. Возможно даже пренатальное исследование, позволяющее устанавливать отцовство в процессе беременности, то есть до рождения ребенка.
В нашей стране значимость молекулярно-генетических идентификационных исследований постоянно возрастает - как по причине сохраняющегося высокого уровня криминогенности, так и в связи с участившимися случаями природных и техногенных катастроф, локальных вооруженных конфликтов и террористических актов. Лаборатории молекулярно-генетического профиля организованы в территориальных экспертных учреждениях Минздрава России, а также в системе МВД, ФСБ и Министерства обороны РФ.
НАУЧНЫЕ ОСНОВЫ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ИДЕНТИФИКАЦИИ ЛИЧНОСТИ
В криминалистике практические идентификационные исследования предполагают выявление и регистрацию таких признаков и свойств объекта, которые можно считать индивидуальными. В судебно-биологической идентификационной экспертизе в роли индивидуальных признаков человека традиционно выступали биохимические маркеры. К ним относятся некоторые антигенные характеристики крови и тканей организма, а также изоформы ряда ферментов, определяемые при изучении следов на вещественных доказательствах, выделений или тканей тела человека.
Индивидуализирующие возможности маркерных систем зависят от их полиморфности, другими словами, от степени их вариабельности и количества вариантов в популяции. Чем эти величины больше, тем выше специфичность маркера, а значит, его способность выделять конкретный объект среди других, даже сходных по иным признакам.
У всех известных биохимических маркеров индивидуализирующий потенциал оказывается недостаточно высок для позитивной идентификации, то есть собственно для отождествления объектов. Например, некоторые биологические характеристики, выявляемые классическими серологическими маркерами - эритроцитарными антигенами системы АВО, встречаются у каждого третьего или четвертого индивидуума. Очевидно, что вероятность их случайного совпадения у разных людей достаточно велика.
Таким образом, биохимические маркеры являются группоспецифическими и потому отождествление если и возможно, то с использованием многих разных систем, каждая из которых, взятая изолированно, имеет лишь относительное значение. Это означает, что существующие методики классического биохимического и иммунологиче-ского анализа, на которых в значительной мере основано получение экспертных оценок при судебно-биологической идентификации личности, способны лишь исключить с достаточной степенью достоверности принадлежность исследуемого биологического материала конкретному лицу. Позитивная же идентификация почти всегда носит условный характер и ограничивается констатацией только групповой принадлежности биологических объектов. Прогресс молекулярно-биологической науки открыл новые пути решения проблемы судебно-медицинской идентификации личности, обеспечив возможность выявления индивидуализирующих личность признаков на уровне не фенотипа, а генетической матрицы - клеточной ДНК.
Молекулярно-генетические маркерные системы основаны на существовании различий в структуре ДНК (генов) у разных индивидуумов. Гомологичные гены, то есть те, что определяют формирование одного и того же признака, например, форму носа или цвет глаз, у разных людей могут находиться в разных аллельных состояниях. На молекулярном уровне аллельные варианты одного и того же гена отличаются небольшими изменениями в структуре их ДНК, конкретно, в последовательности нуклеотидов в полинуклеотидной цепи. Возможны замена единичных нуклеотидов, так называемые точковые замены, или локальные перестройки, именуемые делециями и инсерциями - соответственно утрата либо добавление небольших участков цепи. Столь незначительные различия в конечном итоге и определяют то, чем разные люди отличаются друг от друга: уникальное сочетание аллельных вариантов всех генов обеспечивает биологическую индивидуальность каждого человека.
Выявление этих различий как индивидуализирующих характеристик требует специальных методов и подходов, позволяющих работать непосредственно с молекулами ДНК. Но даже при наличиии такой возможности определение в молекулах ДНК дифференцирующих признаков - весьма непростая задача. Геном человека содержит десятки тысяч генов и состоит из более чем 3 млрд. нуклеотидных пар, при этом молекулы ДНК любых двух людей (неродственников) отличаются в среднем только одним нуклеотидом из каждых трехсот-четырехсот. Но даже такие отличия, как правило, носят характер случайных отклонений от некой доминирующей нормы. Теоретически это означает, что если у сотни человек проанализировать фрагмент ДНК длиной 300-400 нуклеотидов для одного и того же среднестатистического гена, то девяносто девять человек вполне могут оказаться неотличимыми друг от друга. Практическое значение для целей генетической индивидуализации личности (как предпосылки для ее идентификации) имеют отнюдь не любые гены, а только такие, у которых много аллельных форм.
На практиков качестве маркеров индивидуальности выступают мультиаллельные гипервариабельные гены (гипервариабельные генетические локусы). Индивидуализирующими характеристиками служат многочисленные структурные варианты таких локусов, которые в разных сочетаниях присутствуют в ДНК разных индивидуумов. Открытие в начале 1980-х годов феномена локального генетического гиперполиморфизма в лаборатории Р. Уайта в США и позже разработка А. Джеффрисом высокоэффективных молекулярных зондов типа минисателлитной ДНК предоставили новые, недостижимые ранее возможности для решения проблемы индивидуализации человека и установления кровнородственных связей.
ТЕХНОЛОГИИ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ИНДИВИДУАЛИЗАЦИИ
В судебно-экспертной практике базовыми молекулярно-генетическими технологиями признаны: анализ полиморфизма (вариабельности) длины рестриктазных фрагментов ДНК, анализ полиморфизма длины амплифицированных фрагментов ДНК и анализ полиморфизма нуклеотидных последовательностей (сайт-полиморфизма) ДНК.
Анализ полиморфизма длины рестриктазных фрагментов ДНК. Большая часть вариаций в полинуклеотидной цепи геномной ДНК вызвана точковыми нуклеотидными заменами и некоторыми другими вариантами реорганизации нуклеотидных последовательностей - инверсиями, делециями и инсерциями. В результате в молекулах ДНК появляются новые или утрачиваются существовавшие ранее участки воздействия (сайты) особых ферментов - рестрикционных эндонуклеаз (рестриктаз), в которых они расщепляют полинуклеотидные цепи ДНК. Это, в свою очередь, обусловливает изменение длины получающихся рестриктазных фрагментов ДНК. Интересующие фрагменты ДНК можно визуализировать путем молекулярной гибридизации с соответствующим зондом; данный метод хорошо известен в молекулярной биологии нуклеиновых кислот как блот-гибридизационный анализ (рис. 2). С его помощью полиморфные участки генома обнаруживаются в виде имеющих разную длину гомологичных фрагментов ДНК, которые образуются после гидролиза геномной ДНК рестриктазами. Этот феномен получил название полиморфизма длины рестриктазных фрагментов (ПДРФ) ДНК.
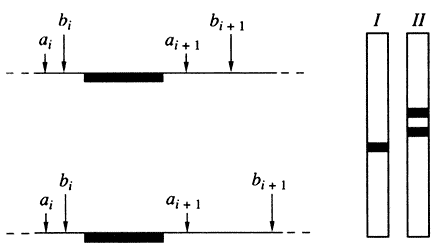
Рис. 2. Схема блот-гибридизации фрагментов ДНК
Слева - схема расположения на гомологичных хромосомах соседних участков узнавания (ai и ai+1; bi и bi+1) двух рестриктаз (I и II), зачерненный участок - область гомологии зонда; справа - схематическая картина результата блот-гибридизации с данным зондом суммарной ДНК, гидролизованной рестриктазами I и II Индивидуальный полиморфизм длины рестриктазных фрагментов создает предпосылки для решения задач, связанных с индивидуализацией организма и установлением его биологических родственных связей с другими индивидуумами. Однако большинство полиморфных геномных локусов - потенциальных генетических маркеров - имеет только два варианта: дикий тип/мутация, то есть являются диморфными или диаллельными. Ценность диморфных маркеров невелика, потому что у многих людей может оказаться один и тот же вариант такого гена. Поэтому, как уже указывалось, индивидуализирующее значение имеют не любые, а только гипервариабельные полиморфные фрагменты.Поскольку гипервариабельные локусы мультиаллельны, то информативность маркерных систем на их основе намного выше, чем информативность систем (как правило, диаллельных), базирующихся на единичных нуклеотидных заменах. Теоретически можно предполагать, что высокая локальная генетическая вариабельность вызвана не столько точковыми нуклеотидными мутациями или микроделециями/инсерциями, сколько другими механизмами, приводящими к более существенной реорганизации геномных последовательностей: транспозициями, неравными или незаконными рекомбинациями, проскальзыванием репликативного комплекса и т.п. Как оказалось, такие локусы достаточно распространены в геноме человека.
Наиболее примечательны из них "минисателлитные" ДНК, впервые описанные в уже упоминавшейся работе Джеффриса. Это относительно короткие (10-60 нуклеотидных пар), рассеянные по геному, повторяющиеся нуклеотидные последовательности, имеющие тандемную организацию и демонстрирующие разную степень внутри-групповой гомологии. Число тандемных повторов в минисателлитных блоках (и следовательно, длина самих блоков) варьируется в широких пределах - от трех-четырех до нескольких тысяч; такие блоки представляют разные аллельные варианты мультиаллельных генетических локусов. В 1987 г. И. Накамура предложил называть такого рода генетические элементы локусами с варьирующимся числом тандемных повторов (рис. 3), или просто тандемными повторами с переменным числом звеньев (общепринятая английская аббревиатура VNTR - Variable Number Tandem Repeat).
Рис. 3. Последовательности ДНК с варьирующимся числом тандемных повторовВверху - варианты таких локусов А, Б, В и Г различаются по длине на один повторяющийся сегмент, сайты рестрикции отмечены стрелками; внизу - схематическая картина блот-гибридизации с молекулярным зондом, гомологичным тандемному повтору, некоторых гетерозиготных по данному локусу ДНК
Вариации числа повторяющихся элементов в VNTR-блоках как раз и обусловливают структурный полиморфизм этих локусов, проявляющийся в форме ПДРФ. Дело в том, что длина соответствующих рестриктазных фрагментов, если отсутствуют участки расщепления внутри самих повторов (из-за их достаточно простого нуклеотидного состава), зависит от числа повторяющихся единиц.
Пожалуй, наиболее значимое свойство открытых Джеффрисом минисателлитов - их существование в виде семейств, диспергированных по геному. Все локусы каждого семейства содержат наборы тандемных олигонуклеотидных последовательностей, объединяемых одним нуклеотидным "мотивом", или кор-последовательностью. Таким образом, помимо мультиаллельности, то есть полиморфизма, обусловленного переменным числом повторяющихся элементов в самих локусах, минисателлитные маркеры характеризуются еще и "системным" полиморфизмом - возможностью одновременного выявления аллельных вариантов сразу нескольких (часто генетически не сцепленных между собой) локусов, представляющих одно семейство. В результате информативность таких гиперполиморфных мультилокусных систем оказывается предельно высокой, в принципе, достаточной для доказательной индивидуализации человека. В настоящее время неизвестно общее число семейств гипервариабельных локусов в геноме человека, но, по-видимому, оно достаточно велико; каждое из них потенциально представляет собой мультилокусную гипервариабельную систему с очень высоким индивидуализирующим потенциалом.
Для реализации потенциала мультиаллельных ПДРФ-маркеров в середине 1980-х годов был разработан комплекс гибридизационных методик с использованием ДНК-зондов, позволяющих эффективно выявлять индивидуально-специфичные наборы аллельных вариантов гипервариабельных локусов в геноме человека. Молекулярный зонд специфичен либо к индивидуальному локусу (монолокусная система), либо к целому семейству таких локусов (мультилокусная система). Для выявления участков геномной ДНК, гомологичных зонду, используются радиоавтография, нерадиоактивные методы детекции, такие как флуоресцентная визуализация, хромогенные иммунохимические реакции и т.п. На конечном этапе работы формируется оценочный графический образ: поперечно исчерченная чередующимися полосами дорожка (рис. 4).
|
полученные с помощью меченного дигоксигенином молекулярного зонда (САС)5 И. Эпплена (слева) Рис. 5. Геномные "отпечатки" четырех неродственных
индивидуумов,
Для каждого индивидуума (если это не монозиготные близнецы), характерен свой, присущий только ему набор отличающихся по длине минисателлитных фрагментов, который при электрофоретическом анализе выявляется как индивидуально- специфичная нерегулярная "лестница" из поперечных полос, большая часть которых у неродственников не совпадает. У близких родственников число совпадений полос может быть существенно больше |
Графическая индивидуальность этого геномного "отпечатка" выражается в числе полос и их расположении на дорожке, ведь для каждого индивидуума характерен свой, присущий только ему вариант набора отличающихся по длине минисателлитных фрагментов.
К концу 80-х годов в судебно-медицинской экспертной практике были апробированы несколько мультилокусных зондов, аналогичных мультилокусным зондам Джеффриса. К их числу относятся разработанная в Институте молекулярной биологии АН СССР и независимо в Бельгии система М13, родственная ей немецкая MZ 1.3, а также японская система Муо, открытая бразильскими учеными система F10, зонды на основе так называемых простых последовательностей, созданные в ФРГ И. Эппленом. На рисунке 5 приведены геномные "отпечатки" нескольких индивидуумов, полученные с использованием зонда М13 для анализа рестриктазного гидролизата суммарной геномной ДНК человека. Эта технология с 1988 г. применялась в Бюро Главной судебно-медицинской экспертизы Минздрава России, однако начиная с 1992 г. постепенно была вытеснена более прогрессивными методами, основанными на полимеразной цепной реакции. В мировой практике интерес к ПДРФ-системам также постепенно снизился, и в настоящее время они практически не применяются, уступив место амплификационным системам.
Анализ полиморфизма длины амплифицированных фрагментов ДНК. Не требующий использования рестрикционных ферментов и отличающийся чрезвычайно высокой чувствительностью, подобный анализ стал возможным в результате внедрения в практику метода так называемой энзиматической амплификации гипервариабельных генетических локусов с помощью полимеразной цепной реакции (ПЦР). Сейчас области применения этой реакции как в фундаментальной науке, так и в биотехнологии столь разнообразны и многочисленны, что трудно их даже перечислить. Главный же смысл этого открытия в том, что удалось преодолеть все ограничения молекулярно-генетических методов исследования, которые были связаны с недостаточным для анализа количеством ДНК.
Полимерная цепная реакция позволяет выделить и размножить любую необходимую для анализа последовательность ДНК в количестве, превышающем исходное в десятки и даже сотни миллионов раз. Такая высокая степень направленного обогащения теоретически позволяет работать с единичными молекулами ДНК, следовательно, открывается возможность молекулярно-генетического типирования даже в случае исчезающе малых количеств доступного для экспертизы биологического материала. Действительно, еще в 1986 г. Джеффрис экспериментально доказал, что с помощью ПЦР реальной становится задача геномной идентификации на уровне нескольких или даже одной клетки. Кроме того, ПЦР весьма эффективна при анализе сильно разрушенных ДНК, подвергшихся высокой степени деградации.
Метод энзиматической амплификации ДНК положен в основу создания высокоспецифичных диагностических и индивидуализирующих тест-систем. Все они разрабатываются по единому принципу, который заключается в подборе праймеров на известной последовательности нуклеотидов ДНК (как правило, это олигонуклеотиды длиной 20-25 нуклеотидов, которые располагаются по флангам высокополиморфных мультиаллельных локусов) и оптимизации условий энзиматической амплификации выбранных генетических локусов. Процесс амплификации включает повторяющиеся циклы температурной денатурации ДНК, молекулярную ассоциацию ("отжиг") праймеров с комплементарными им последовательностями на ДНК-матрице и последующую матричную достройку полинуклеотидных цепей (начиная от этих праймеров) особым ферментом - термостабильной ДНК-зависимой ДНК-полимеразой, выделенной из бактерии Thermus aquaticus. Праймеры ориентированы таким образом, что синтез с помощью полимеразы осуществляется только между ними, удваивая в каждом цикле количество копий этого участка ДНК. В результате происходит экспоненциальное увеличение числа амплифицирумых фрагментов: за 20-30 циклов амплификации количество синтезированных молекулярных копий исходного фрагмента составит примерно 1 млн.
Как мы уже знаем, гипервариабельные локусы VNTR-типа содержат различное число повторяющихся элементарных звеньев. При амплификации с праймерами, расположенными по краям такого локуса, образуются фрагменты ДНК различной длины, причем длина фрагмента будет пропорциональна числу повторов. Таким образом, в данной аналитической системе любой индивидуальный образец ДНК человека характеризуется наличием двух амплифицированных фрагментов разной или одинаковой длины (соответственно, гетерозиготное и гомозиготное состояние), поскольку каждая из двух гомологичных хромосом несет свой вариант гипервариабельного локуса, который может отличаться от других числом содержащихся в нем тандемных повторов. Этот феномен получил название полиморфизма длины ямплифицированных фрагментов (ПДАФ) ДНК.
Молекулярные копии амплифицируемого локуса ДНК накапливаются в реакционной смеси, вследствие чего количественно оказываются доступными для сравнительного анализа. Далее полученные амплификационные продукты фракционируют с помощью электрофореза в геле агарозы или полиакриламида, фрагменты ДНК, амплифицированные в ходе реакции, выявляют, используя различные методы детекции. Собственно идентификационный анализ ПДАФ хромосомной ДНК в целом аналогичен монолокусному анализу ПДРФ: полиморфные по длине фрагменты, представляющие (как и в случае рестриктазных фрагментов в анализе ПДРФ) разные аллельные варианты гипервариабельных локусов, выступают в качестве индивидуализирующих личность признаков. Они регистрируются в виде индивидуально-специфичного набора из двух полиморфных фрагментов (две полосы на электрофореграмме), характеризующихся определенным расположением на дорожке геля. Этот так называемый амплификационный профиль ДНК и является индивидуализирующей геномной характеристикой человека, которому принадлежит анализируемая ДНК (рис. 6).
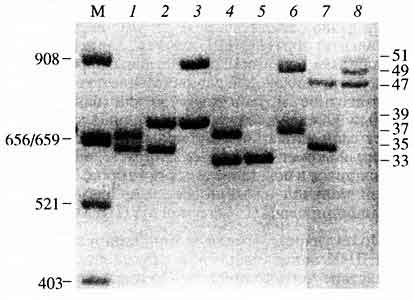
Рис. 6. Электрофореграмма (окрашивание серебром)
амплифицированных фрагментов ДНК - аллелей
хромосомного локуса ApoB-3'VNTR (2р24-р23) восьми неродственных индивидуумовСправа указаны номера аллельных вариантов, присутствующих в данной выборке (номер аллеля отражает число тандемных повторов), слева - размеры в парах нуклеотидов, М - стандарт молекулярных масс Alul-гидролизат ДНК плазмиды pBR322. Каждый индивидуум обладает двумя полиморфными фрагментами (две полосы на электрофореграмме), характеризующимися определенным расположением на дорожке геля. В большинстве случаев этот набор из двух полос у неродственников не совпадаетЧаще всего полосы на электрофореграмме визуализируют с помощью красителя этидиумбромида в ультрафиолетовом излучении или путем окрашивания нитратом серебра. В последнее время, однако, все более активно внедряется регистрация амплифицированных фрагментов ДНК с использованием более чувствительных методов детекции, например, с помощью флуоресцентных меток, возбуждаемых лазерным излучением. Подобные методы требуют специального аппаратного обеспечения и относительно дороги, но они анализируют картину электрофоретического разделения с очень высокой точностью в режиме реального времени. Кроме того, открывается возможность разработки мультиплексных амп-лификационных систем, которые позволяют одновременно анализировать ПДАФ сразу нескольких локусов (их может быть больше десятка). Создаваемый уже суммой локусов амплификационный профиль ДНК оказывается чрезвычайно полиморфным, ведь он является комбинацией нескольких независимых полиморфных элементов, что и обусловливает его очень высокую индивидуальную специфичность (рис. 7).
| Рис. 7. Типирование хромосомной ДНК шести неродственных
индивидов с помощью мультиплексной амплификационной системы PowerPlex2.1
System (Promega Corp., США)
Эта система позволяет одновременно анализировать ПДАФ девяти хромосомных локусов: Penta E, D18S51, D21SII, THOI, D3S1358, FGA, ТРОХ, D8S1179 и vWA (компьютерный интерпретационный образ трехцветной картины, полученной на аппаратно-программном комплексе Hitachi FMBIO II Fluorescence Imaging System): М - комбинирован-ный аллельный стандарт (представлены все аллельные варианты анализируемых локусов). Суммарный амплификационный профиль ДНК для каждого индивидуума создается комбинацией девяти пар полос, которые у неродственников ведут себя как независимые полиморфные элементы, что обусловливает очень высокую индивидуальную специфичность |
Анализ полиморфизма нуклеотидных последовательностей ДНК. Мы уже отмечали, что существенная часть вариаций в полинуклеотидных цепях геномной ДНК обусловлена точковыми нуклеотидными заменами: очень многие локусы, в том числе и высокополиморфные, имеют варианты (аллели), которые на молекулярном уровне одинаковы по длине, но в той или иной степени различаются последовательностью нуклеотидов. Это так называемый сайт-полиморфизм (от англ. "site" - участок), который условно можно обозначить ППАФ - полиморфизм последовательности амплифицированных фрагментов ДНК. Понятно, что амплификация локусов ДНК, обладающих свойством сайт-полиморфизма, приведет к образованию неразличимых по длине фрагментов. Дифференцировать такие фрагменты с помощью обычных методов электрофореза невозможно, поэтому в индивидуализирующих системах ППАФ-типа используются иные принципы дифференциации аллельных вариантов.
Наиболее радикальный путь - секвенирование амплифицированных фрагментов ДНК, то есть определение первичной структуры полинуклеотидной цепи. Теоретически это самый точный и доказательный метод анализа индивидуальных генетических вариаций, поскольку по своей сути секвенирование означает расшифровку генетического кода, который в принципе уникален для каждого организма. В настоящее время единственной молекулярно-генетической индивидуализирующей системой, основанной на секвенировании сайт-полиморфных амплифицированных фрагментов ДНК, являются полиморфные локусы митохондриальной ДНК (мтДНК).
Митохондриальная ДНК человека представляет собой кольцевую молекулу, которая имеет размер 16 569 пар нуклеотидов (рис. 8) [8]. Предполагается, что мтДНК эволюционировала из хромосомы свободноживущей бактерии. Полтора-два миллиарда лет назад предки митохондрий перешли к эндосимбиотическому образу жизни в составе эукариотической клетки, и за прошедший период времени значительная часть генов исходной бактериальной хромосомы была утрачена или переместилась в ядро. У некоторых организмов этот процесс зашел гораздо дальше, и сейчас мтДНК человека насчитывает всего 37 генов. Она характеризуется рядом уникальных биологических свойств: быстрым темпом мутирова-ния и, как следствие, высоким уровнем изменчивости, большим числом копий в каждой клетке, материнским характером наследования и отсутствием рекомбинации. Эти свойства, ставшие причиной широкого использования мтДНК в популяционных и эволюционных исследованиях, делают ее высокоинформативным, а в некоторых случаях единственно применимым инструментом и в судебно-медицинской практике.
Рис. 8. Карта митохондриального генома человека [9] соответственно, легкой и тяжелой цепей митохондриальной ДНКОтмечены гены, локализованные на митохондриальной ДНК, и
сайты инициации транскрипции (РL и PH) и репликации (OL и OH),Можно использовать мтДНК как генетический маркер материнской линии наследования, и особенно успешно при установлении родства в тех случаях, когда генетическая дистанция, разделяющая родственников, больше, чем одно поколение. Здесь аутосомные маркеры не дают доказательного результата, поскольку практически невозможно проанализировать очень большое количество вариантов их наследования в ряду поколений. Нуклеотидная же последовательность мтДНК идентична у всех родственников, связанных материнской линией родства (за исключением редких мутационных событий). По этой причине для установления принадлежности индивида к конкретной генетической линии, а следовательно, для его косвенной идентификации, можно использовать сравнительный анализ мтДНК любых родственников индивида по материнской линии (сестра, бабка, дядя, племянник и т.д.).
Анализ мтДНК возможен, если для экспертного исследования доступны крайне малые количества биологического материала или ДНК, содержащаяся в образце, сильно деградирована и хромосомная ДНК не может быть амплифицирована. Митохондриальная ДНК многократно использовалась для анализа костных останков, возраст которых исчисляется десятками, сотнями и даже десятками тысяч лет [10-13]. Такие результаты недостижимы для индивидуализирующих систем, основанных на анализе однокопийных генов хромосомной ДНК.
Высокий уровень изменчивости мтДНК обеспечивает широкий спектр индивидуализирующих характеристик, а значит, и высокий дискриминирующий потенциал данного метода. Поскольку мтДНК не подвержена рекомбинации, она должна рассматриваться как единый локус. Количество вариантов последовательности контрольного региона мтДНК существенно превышает количество аллелей любого, даже самого полиморфного хромосомного маркера. Полиморфизм мтДНК столь высок, что иногда один лишь его анализ может обеспечить достаточно надежное подтверждение родства.
Вариации в полинуклеотидных цепях мтДНК обусловлены в основном точковыми нуклеотидными заменами - типичный полиморфизм последовательности ДНК. При типировании мтДНК в судебно-экспертных идентификационных исследованиях используются анализ полиморфизма длины рестриктазных и амплифицированных фрагментов (ПДРФ, ПДАФ), анализ полиморфизма нуклеотидных последовательностей (ППАФ, SSO, гибридизационные микроматрицы) и анализ конформационного полиморфизма (SSCP, DGGE). Тем не менее следует отметить, что из них практическое значение имеет только индивидуализирующая система ППАФ-типа, в основе которой лежит секвенирование амплифицированных фрагментов ДНК, синтезированных на матрице мтДНК. Такой анализ, предусматривающий прямое секвенирование амплифицированного продукта, дает полную информацию о первичной структуре исследуемого фрагмента (рис. 9).
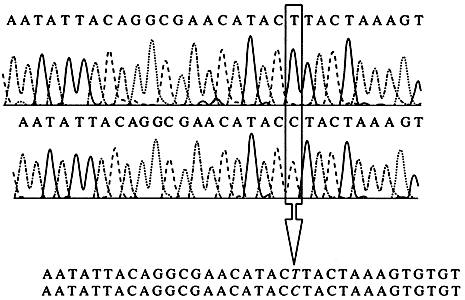
Рис. 9. Выявление нуклеотидных замен в митохондриальной ДНК
методом прямого флуоресцентного секвенированияРезультаты получены на аппаратно-программном комплексе АВ1377 PRISM (РЕ Biosystems, США)
ПРАКТИКА СУДЕБНО-МЕДИЦИНСКОЙ ЭКСПЕРТИЗЫ
Мы уже говорили, что применительно к задачам судебно-медицинской экспертизы молекулярно-генетический идентификационный анализ наиболее эффективен в двух случаях: идентификация личности и установление биологического родства (в наиболее распространенном варианте - экспертиза спорного отцовства). Под идентификацией понимается, во-первых, задача экспертизы по конкретному уголовному или гражданскому делу, и во-вторых, собственно процесс и результат экспертизы, который заключается в установлении тождества исследуемых объектов (а в случае отрицательного результата - их дифференциации). Предпосылкой для идентификации объекта является его индивидуализация: процесс выявления и оценки признаков объекта, обладающих максимальной значимостью с точки зрения его неповторимости, то есть отличия от лн^ых иных объектов. Отождествление или дифференциация осуществляются на основании сравнительного анализа совокупности индивидуализирующих признаков ДНК, выявленных в ходе идентификационного исследования.
Индивидуализирующие системы на основе анализа ПДАФ хромосомной ДНК. В настоящее время в мировой судебно-экспертной практике применяется несколько десятков молекулярно-генетических ПДАФ-систем на основе полиморфных локусов. В Российской Федерации использование этой технологии регламентируется Методическими указаниями Минздрава России от 19 января 1999 г. [14]. В качестве индивидуализирующих признаков выступают генотипические комбинации аллелей полиморфных генетических локусов. Эти аллели, в зависимости от используемого методического подхода, визуализируются (регистрируются) в виде полос, которые образуют полиморфные фрагменты ДНК на электрофореграмме. Такие индивидуально-специфичные наборы полос, представляющие генотипические аллельные комбинации индивида, можно назвать локальными геномными профилями.
Результаты сравнительного исследования (совпадение - несовпадение) геномных профилей идентифицирующего объекта (ими могут быть как биологические образцы, заведомо происходящие от устанавливаемого субъекта, так и объекты неизвестного происхождения, связанные с расследуемым событием - вещественные доказательства, следы биологической природы и т.п.) и идентифицируемого лица отражаются в выводах о вероятном тождестве этих объектов экспертизы или их безусловном отличии. Вероятностная оценка генетической идентичности объектов экспертизы строго обязательна. Это требование диктуется необходимостью принимать во внимание возможность случайного совпадения индивидуализирующих признаков разных индивидуумов.
Наследование аллельных вариантов каждого полиморфного локуса происходит по ядерному типу, то есть примерно половина всех маркерных элементов, составляющих локальный геномный профиль каждого человека, ведет начало от его отца, а другая половина - от матери. Такой характер наследования обусловлен аутосомной локализацией гипервариабельных локусов: каждый аллельный вариант наследуется как простой менделевский кодоминантный признак.
Экспертиза спорного отцовства по сути также является идентификационным тестом. Однако в отличие от прямой судебно-медицинской идентификации личности отождествление здесь носит опосредованный характер. Если пользоваться криминалистической терминологией, признаки "образующего" объекта (в данном случае - родительского индивидуума), используемые с целью идентификации, отражаются в "воспринимающем" объекте - ребенке - не непосредственно, как в биологических следах, а преломляются через призму сложных генетических закономерностей. Знание и правильная оценка этих закономерностей необходимы для адекватной интерпретации результатов экспертного иследования.
Идентификационный тест, направленный на разрешение случаев оспариваемого отцовства, предполагает сравнительный анализ геномных профилей ребенка, матери и предполагаемого отца. При этом сначала регистрируют те полосы в геномном отпечатке ребенка, позиции которых совпадают с материнскими полосами, а оставшиеся полосы у ребенка сопоставляют с геномным профилем мужчины. Если исследуемое трио представляет собой истинную биологическую семью, все нематеринские полосы ребенка обнаружатся в геномном профиле отца. В противном же случае часть полос в локальных геномных профилях ребенка окажется "лишними", то есть не найдет соответствия в геномных профилях заявленных родителей (рис. 10). Этот стандартный алгоритм решения данной экспертной задачи базируется на закономерностях наследования гипервариабельных локусов. В частности, опираясь на менделевский кодоминантный характер наследования, можно считать, что все полосы, составляющие геномный профиль ребенка, должны иметь либо отцовское, либо материнское происхождение. Присутствие у ребенка посторонних фрагментов служит основанием для исключения заявленного отцовства (при условии, что материнство рассматривается как бесспорное). В свою очередь, полное комплементарное соответствие геномных профилей ребенка и заявленных родителей означает неисключение заявленного родства.
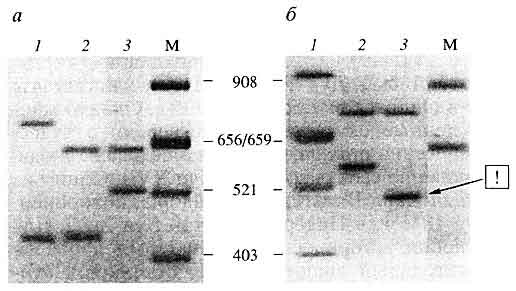
Рис. 10. Электрофореграмма (окрашивание серебром)
амплифицированных фрагментов ДНК - аллелей хромосомного VNTR-локуса DIS80 (1р36-р35) трех индивидуумова - истинная семейная группа - мать, ребенок и отец (1, 2 и 3, соответственно);
б - ложная семейная группа - мать, ребенок и лжеотец; стрелкой отмечен отцовский аллель ребенка, который отсутствует в ДНК неродственного мужчины;М - стандарт молекулярных масс Alul-гидролизат ДНК плазмиды pBR322, приведены размеры в парах нуклеотидов Индивидуализирующая система на основе анализа ПДАФ митохондриальной ДНК. Особая ценность данного методического подхода обусловлена тем обстоятельством, что в целом ряде случаев для экспертизы могут быть недоступны идентифицирующие объекты, которые позволили бы прямо установить индивидуализирующие признаки погибших на уровне их хромосомной ДНК. Остается возможность только непрямой идентификации, например, путем использования в качестве идентифицирующих объектов биологических образцов, полученных от родственников устанавливаемых лиц. Однако в этих условиях решение судебно-медицинской задачи идентификации с помощью стандартного молекулярно-генетического анализа хромосомных маркеров сталкивается с серьезными трудностями.
Проблема в том, что единственно возможная в таких обстоятельствах схема непрямой, то есть опосредованной через родственников, идентификации дает доказательный результат, если только в качестве индивидуализирующих элементов используется достаточно большое число полиморфных хромосомных локусов. Кроме того, часто приходится анализировать не близкородственную вертикальную схему "родители-дети", а более далекую, например, "дед/бабка-внук" или "дядя/тетка-племянник" либо же горизонтальные схемы типа "брат-сестра" (в отсутствие родителей). В этих случаях речь идет о достаточно отдаленном родстве и о более вариантных схемах наследования ядерных генов-признаков. Когда генетическая дистанция, разделяющая родственников по вертикали, превышает одно поколение, или анализируются горизонтальные схемы родства, верификация родственных связей с помощью анализа одной лишь хромосомной ДНК оказывается проблематичной.
Напротив, типирование митохондриальной ДНК, по существу, позволяет выявлять родственные связи с помощью не близкородственных, а так сказать, трассирующих родословных маркеров. Одним из первых и наиболее ярких примеров использования митохондриальной ДНК в экспертном исследовании стала идентификация останков членов российской императорской семьи [10, 15]. Читатели "Вестника" знакомы с этой историей [16]. Данная экспертиза положила начало серии работ, основанных на анализе мтДНК и проливающих свет на исторические события прошлого.
Такова, например, экспертиза предполагаемых останков нацистского преступника Мартина Бормана [17]. На протяжении многих лет была распространена легенда о том, что Борману удалось остаться в живых и после окончания войны покинуть Германию. В 1972 г. в ходе строительных работ были обнаружены костные останки, которые по ряду косвенных признаков могли принадлежать Борману. Для окончательного пресечения спекуляций было проведено исследование мтДНК костных останков, которое выявило полное совпадение с мтДНК ныне живущих матрилинейных родственников Бормана. Такое совпадение с большой вероятностью подтвердило принадлежность костных останков исторической фигуре.
К событиям более далекого прошлого относится экспертиза предполагаемых останков принца Луи XVII [12]. Согласно официальной истории, 10-летний сын Луи XVI и Марии-Антуанетты умер в парижской тюрьме в 1795 г. Однако многочисленные слухи свидетельствовали о чудесном спасении принца. Обнаружились даже люди, объявившие себя спасенным Луи XVII. Одним из них был Карл Вильгельм Наундорф, похороненный в 1845 г. в Нидерландах как Луи XVII. Для выяснения исторической истины был проведен сравнительный анализ мтДНК останков Наундорфа и ныне живущих родственников Марии-Антуанетты и параллельно - анализ мтДНК сохранившегося сердца мальчика, скончавшегося в 1795 г. в парижской тюрьме. Исследование исключило родство Наундорфа с родственниками Марии-Антуанетты (а следовательно, и его права наследника), поскольку выявило различия в их мтДНК, и установило совпадение нуклеотидных последовательностей мтДНК сердца и матрилинейных родственников Луи XVII, тем самым подтвердив официальную версию исторических событий.
В Российской Федерации судебно-экспертное использование методов типирования митохондриальной ДНК регламентируется Методическими указаниями от 26 января 2001 г. Минздрава России № 4/2001 "Применение молекулярно-генетической индивидуализирующей системы на основе полиморфизма нуклеотидных последовательностей митохондриальной ДНК в судебно-медицинской экспертизе идентификации личности и установления биологического родства". С помощью этой технологии выполнен ряд идентификационных экспертиз по особо сложным уголовным делам, связанным с тяжкими преступлениями против личности. Экспертизы продемонстрировали эффективность технологии в части доказательного установления или исключения причастности подозреваемого лица к совершенному преступлению, позволили установить личности неопознанных погибших, идентификация которых оказалась невозможна с помощью каких-либо других методов. Примером может служить идентификация останков генерала МВД Г.Н. Шпигуна - заложника, погибшего в Чеченской Республике в 2000 г., идентификация останков украинского журналиста Г. Гонгадзе в 2001 г.
Применение методов типирования митохондриальной ДНК позволило получить первый в стране положительный опыт решения идентификационных задач при судебно-медидинской экспертизе массовых неопознанных Человеческих останков. Речь идет о масштабных экспертизах неопознанных останков людей, погибших в результате террористических актов, совершенных в Москве в сентябре 1999 г. [18] и во время вооруженного конфликта 1994-1996 гг. в Чеченской Республике [19].
Напомним, что в сентябре 1999 г. в Москве были совершены взрывы двух жилых домов, повлекшие смерть более 200 граждан. Прокуратура г. Москвы приняла к рассмотрению заявления граждан о розыске родственников, которые находились в моменты взрывов в указанных домах, но их судьба оставалась неизвестной, поскольку тела не были опознаны среди погибших. На месте взрывов обнаружили 76 фрагментов тел, которые, однако, не представлялось возможным идентифицировать с помощью традиционных методов судебной медицины. Была назначена молекулярно-генетическая экспертиза.
Осложняющим обстоятельством явилось то, что для экспертизы были недоступны идентифицирующие объекты, которые позволили бы прямо установить индивидуализирующие признаки погибших на уровне их хромосомной ДНК. Оставалась только возможность косвенной идентификации, например, путем использования в качестве идентифицирующих объектов биологических образцов, полученных от родственников погибших. Однако такая схема не прямой, а опосредованной через родственников идентификации не может дать доказательный результат с помощью анализа одной лишь хромосомной ДНК. Радикальным решением проблемы в данном случае явилось применение (в дополнение к анализу полиморфизма хромосомных генов) сравнительного анализа нуклеотидных последовательностей митохондриальной ДНК в объектах экспертизы.
На основании комплекса исследований по типированию мтДНК была осуществлена молекулярно-генетическая индивидуализация всех фрагментированных останков неопознанных тел, найденных на местах взрывов домов. Установлено, что эти фрагменты являются останками 27 человек. По результатам сравнительного анализа полученных профилей полиморфизма нуклеотидных последовательностей мтДНК была осуществлена доказательная идентификация останков граждан, проживавших в указанных домах и погибших в момент их взрывов. Идентифицированы останки 11 человек, в том числе 6 - из списка разыскиваемых (на момент начала данной экспертизы всего по двум взрывам - 21 человек) и 6 - фрагменты от ранее опознанных и захороненных трупов. Кроме того, фрагменты 16 тел не принадлежали никому из разыскиваемых граждан.
Аналогичные экспертные алгоритмы были нами реализованы при выполнении дополнительных идентификационных исследований по поручению Штаба тыла Минобороны России - при типировании митохондриальной ДНК в образцах биологических тканей от неопознаваемых трупов военнослужащих, погибших во время вооруженного конфликта 1994-1996 гг. в районе Чеченской Республики, и от матрилинейных родственников лиц, пропавших без вести в период указанных военных действий. Для более чем 50 тел и 250 образцов крови были установлены идентифицирующие признаки мтДНК; их. сравнительный анализ заключался в верификации предложенных для экспертной разработки идентификационных ориентировок на возможную принадлежность исследованных останков конкретным безвестно отсутствующим лицам.
Возникшая на базе новейших достижений академической" биологической науки, технология генетической индивидуализации поначалу лишь обозначила перспективы, указала новые возможные пути решения целого ряда специальных задач в медицинской генетике, генеалогических исследованиях и близнецовом анализе, эпидемиологии, селекции, популяционой и эволюционной генетике, и наконец, судебной биологии и криминалистике. Очевидно, что реализация этих возможностей неизбежно потребовала дальнейшей углубленной разработки, модификации и адаптирования метода в русле каждого конкретного направления. Что касается судебно-медицинских аспектов генетической идентификации, то здесь экспертный идентификационный анализ продолжает свое развитие уже не только как область молекулярно-генетических исследований, но и как элемент комплексного криминалистического знания, направленного на расследование и раскрытие преступлений. * * *
ЛИТЕРАТУРА
1. Jeffreys AJ., Wilson V., Thein S.L. Individual-specific "fingerprints" of human DNA // Nature. 1985. V. 316. P. 76.
2. Gill P., Jeffreys AJ., Werrett D.J. Forensic application of DNA "Fingerprints" // Nature. 1985. V. 318. P. 577.
3. Рысков А.П., Джинчарадзе А.Г., Иванов ПЛ. и др. Геномная "дактилоскопия" организмов различных таксономических групп: использование в качестве гибридизационной пробы ДНК фага М13// Генетика. 1988. № 2.
4. Ryskov A., Jincharadze A., lvanov P. et al. М13 phage DNA as a universal marker for DNA fingerprinting of animals, plants and microorganisms // FEBS Lett. 1988. V. 233. № 2.
5. Рысков А.П., Джинчарадзе А .Г., Иванов П.Л. и др. Способ определения родства живых организмов. Авторское свидетельство СССР. № 1552642 от 22.11.1989.
6. Иванов ПЛ., Гуртовая С.В., Плаксин В.О. и др. Геномная "дактилоскопия" с использованием в качестве зонда ДНК бактериофага М13 (экспертиза вещественных доказательств и идентификация личности) // Судебно-медицинская экспертиза. 1989. № 4.
7. Иванов ПЛ., Гуртовая С.В., Вербовая Л.В. и др. Геномная "дактилоскопия" в экспертизе спорного отцовства и определения биологического родства // Судебно-медицинская экспертиза. 1990. № 2.
8. Anderson S., Bankier A.T., Barrell B.G. et al. Sequence and organization of the human mitochondrial genome // Nature. 1981. V. 290. P. 457-465.
9. Wallace D.C„ Brown M.D., Lott M.T. Mitochoudrial DNA variation in human evolution and disease // Gene. 1999. V. 238. P. 211-230.
10. Gill P., lvanov P.L., Kimpton C. et al. Identification of the remains of the Romanov family by the DNA analysis //Nature Genetics. 1994. V. 6. P. 130-135.
11. lvanov P.L., Wadhams M.J., Parsons T.J. et al. Mitochondrial DNA sequence heteroplasmy in the Grand Duke of Russia Georgij Romanov: a "Royal" mutation in the Hessian family lineage establishes the authenticity of the remains of Tsar Nicholas II // Nature Genetics. 1996. V. 6. P. 417^25.
12. Jehaes E., Pfeiffer H., Toprak K. et al. Mitochondrial DNA analysis of the putative heart of Louis XVII, son of Louis XVI and Marie-Antoinette // Eur. J. Hum. Genet. 2001. V. 9. P. 185-190.
13. Krings M„ Stone A„ Schmitz R.W. et al. Neandertal DNA sequences and the origin of modem humans // Cell. 1997. V. 90. P. 19-30.
14. Иванов П.Л. Использование индивидуализирующих систем на основе полиморфизма длины амплифицированных фрагментов (ПДАФ) ДНК в судебно-медицинской экспертизе идентификации личности и установления родства // Судебно-медицинская экспертиза. 1999. № 4.
15. Иванов П.Л. Экспертная идентификация останков императорской семьи посредством молекулярно-генетической верификации родословных связей // Судебно-медицинская экспертиза. 1998. № 4.
16. Иванов П.Л. Молекулярно-генетическая идентификация останков царской семьи // Вестник РАН. 1994. №10; Он же. Идентификация останков царской семьи: вклад молекулярной генетики // Вестник РАН. 1996. № 4.
17. Anslinger К., Weichhold G., Keil W. et al. Identification of the skeletal remains of Martin Bormann by mtDNA analysis // Int. J. Legal. Med. 2001. V. 114. P. 194-196.
18. Иванов ПЛ., Жаров В.В., Фролова С.А. и др. Комплексное применение технологий молекулярно-генетической индивидуализации биологических объектов для судебно-экспертной идентификации неопознанных останков жертв террористических актов в Москве в 1999 г. // Судебно-медицинская экспертиза. 2002. № 4.
19. Иванов ПЛ., Фролова С.А., Орехов В.А. и др. Типирование митохондриальной ДНК - новый уровень решения идентификационных задач при судебно-медицинской экспертизе неопознанных останков жертв террористических актов в Москве и вооруженного конфликта в Чеченской Республике // Судебно-медицинская экспертиза. 2001. № 3.