| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
том 71, №5, с. 387-395 (2001) |
| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
том 71, №5, с. 387-395 (2001) |
© А.В. ЗеленинГЕННАЯ ТЕРАПИЯ
НА ГРАНИЦЕ ТРЕТЬЕГО ТЫСЯЧЕЛЕТИЯА.В. Зеленин
Зеленин Александр Владимирович - доктор биологических наук, заведующий лабораторией
Института молекулярной биологии им. В.А. Энгельгардта РАН,
заместитель председателя совета Российской программы "Геном человека".Название этой статьи - не просто дань моде. На всех этапах развития человечества люди пытались тем или иным способом лечить свои недуги, и эти способы менялись и развивались параллельно научному и технологическому прогрессу.
К наиболее древним подходам медицины, по всей видимости, относится то, что сейчас называется лекарственной терапией. С далеких времен люди использовали для лечения заболеваний различные экстракты, вытяжки и отвары из растений и животных, на первых порах даже не задумываясь о химической природе терапевтического эффекта, то есть о тех активно действующих началах (лекарствах), которые в них содержатся. К древнейшим лечебным воздействиям может быть причислена и физиотерапия, важнейшими компонентами которой и поныне остаются солнце, вода и воздух. В Древнем Риме появились зачатки психотерапии, о чем свидетельствует известное высказывание о связи здорового духа и здорового тела.
Стремительное развитие науки в XX столетии, естественно, породило новые области медицинских воздействий. Резко расширилась физиотерапия, которая начала широко использовать действие на организм больного электрического тока, тепла, ультразвукового, высокочастотного и светового излучений. Успехи синтетической химии привели, по образному выражению Пауля Эрлиха, к созданию множества "магических пуль" и возникновению химиотерапии как самостоятельной области терапии лекарственной. Открытие рентгеновского и радиоактивного излучения явилось основой для рентгено- и радиотерапии.
Минувший XX в. ознаменовался поистине триумфальным шествием новой естественно-научной дисциплины - генетики. В его второй половине произошла материализация понятия гена (отрезок нуклеиновой кислоты, ответственный за синтез конкретного белка и определяющий конкретную биологическую функцию), а затем установлена его структура; ген научились выделять, размножать (клонировать), направленно изменять и вводить обратно в организм бактерий, растений и животных, включая человека. Так был разработан принципиально новый подход к лечению человека - генная терапия.
ЧТО ТАКОЕ ГЕННАЯ ТЕРАПИЯ?
Под генной терапией подразумевают медицинский подход, основанный на введении в клетки и организм генных конструкций с лечебной целью [1, 2, 3]. Желаемый эффект достигается либо в результате экспрессии (работы) интродуцированного (введенного) гена, либо за счет частичного или полного подавления функции поврежденного или сверхэкспрессирующего, то есть работающего с вредной для организма интенсивностью, гена. В последнее время осуществляются также попытки коррекции структуры и функции неправильно функционирующего ("больного") гена. Следует специально подчеркнуть, что генная терапия ставит целью лечение не генов, как это иногда считают, а заболевания организма с использованием генов, подобно тому как химиотерапия - это не терапия химика, а рентгенотерапия - не лечение рентгенолога.
Идеи о возможности введения в организм генов с лечебной целью были высказаны еще в начале 60-х годов минувшего века, однако реальные попытки такого рода относятся к концу 80-х годов и практически совпадают с развитием работ по тотальному секвенированию генома человека и созданию международной программы "Геном человека".
В 1990 г. была осуществлена попытка лечения тяжелого, обычно несовместимого с жизнью наследственного иммунологического заболевания (иммунодефицита), вызванного дефектом в гене, который кодирует синтез фермента аденозиндезаминазы (ADA). У двух девочек в возрасте до четырех лет, страдавших врожденным дефектом в гене ADA, были взяты клетки костного мозга и перенесены в так называемую культуру, то есть для них были созданы условия роста вне организма. В эти клетки ввели ген ADA. Затем трансфицированные клетки были размножены в культуре, после чего введены больным, от которых они были получены. Авторы сообщили о четко выраженном лечебном эффекте [1].
И хотя впоследствии возник ряд сомнений в устойчивости полученного эффекта и его конкретных механизмах, именно эта работа послужила мощнейшим толчком для развития генной терапии и вызвала феноменальный приток средств (многие миллиарды долларов США), которые обеспечили лавинообразное нарастание числа генно-терапевтических исследований. Справедливости ради следует отметить, что в последнее время появились сведения о серьезном успехе в генной терапии иммунодефицита [4].
Современные исследования в области генной терапии могут быть разделены на ряд относительно независимых этапов: разработка генных конструкций, проведение на экспериментальных животных так называемых предклинических испытаний и, наконец, осуществление прямых попыток лечения отдельных болезней. Шесть престижных международных журналов целиком посвящены проблемам генной терапии. Ежегодно проводятся десятки международных конгрессов и конференций. В то же время реальные успехи генной терапии в лечении конкретных больных достаточно скромны, и генная терапия все еще находится в стадии накопления данных и развития новых технологий.
ЧТО И КАК ВВОДИТЬ?
Необходимым условием генной терапии является введение генных конструкций в клетки. При этом сразу же возникают вопросы: что, как, куда и в какой форме вводить?
Как правило, в качестве лечебного препарата используется отрезок ДНК, содержащий в своем составе избранный ген. Это может быть просто кусок ДНК, не обработанный никаким специальным образом. Часто его называют "голой ДНК", которую обычно вводят в комплексе с различными липидами, белками и другими носителями, иногда синтетическими. Но чаще всего ДНК помещают в состав специальных генетических конструкций (векторов), созданных на базе разнообразных вирусов человека и животных. С этой целью над молекулой вируса производят генно-инженерные манипуляции, приводящие к удалению из нее части генов, необходимых для размножения вируса. Это, с одной стороны, лишает вирусы их инфекционности и делает их безопасными (или почти безопасными), а с другой, освобождает место для генов, предназначенных для введения в организм. Важно, что вирусные векторы сохраняют свою природную способность легко и быстро распространяться в организме, проникать в клетки и ядра и во многих случаях встраиваться в собственную ДНК клеток.
Векторы создаются на базе различных вирусов. В 40% случаях используются аденовирусы, включая делетированные, в 30% - ретровирусы, в 16% - аденоассоциированные вирусы, в 10% - вирус простого герпеса, в 4% - лентавирусы, вирус папилломы, гибридные вирусные конструкции, в том числе на базе вируса простого герпеса и аденоассоциированного вируса. Вирусы различаются способностью встраиваться или не встраиваться в геном и соответственно длительной или кратковременной экспрессией в клетках, а также специфичностью (тропизмом) к определенным тканям и органам.
Особый характер носят генные конструкции, рассчитанные на подавление генетической функции [1, 5]. Они обычно нацелены на выключение функции информационной РНК (иРНК), кодирующей белок, синтез которого намечено подавить. Синтезируется комплементарная цепь нуклеотидов, которая, соединившись с иРНК, подавляет ее способность служить в качестве матрицы для синтеза белка. В связи с обратным по отношению к иРНК расположением в ней нуклеотидов такая конструкция носит название антисмысловой РНК (antisence RNA) (рис. 1). При своей кажущейся простоте метод имеет много проблем и ограничений: вводимая конструкция должна быть нечувствительной к действию ферментов, расщепляющих нуклеиновую кислоту (нуклеаз), и легко доставляться в необходимом количестве в клетку; образовавшийся с РНК комплекс должен быть стабильным в течение времени, достаточного для реализации лечебного эффекта, и т.д. Часть этих задач решается путем создания "защищенных" аналогов нуклеотидов. Антисмысловые конструкции вводятся в организм либо непосредственно (в виде "голой" нуклеиновой кислоты), либо в составе вирусного вектора.
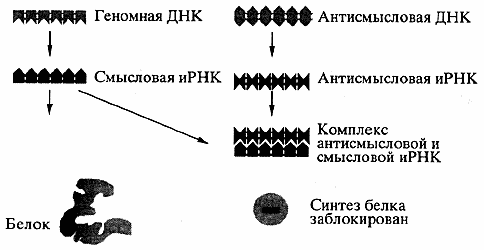
Рис. 1. Схема действия антисмысловой генной конструкции
Критическим условием генной терапии является проникновение лечебного вектора в клетку, в подавляющем большинстве случаев в ее ядро. При этом необходимо, чтобы генная конструкция достигала именно тех клеток, которые нуждаются в коррекции. Поэтому успех генной терапии во многом зависит от выбора оптимального или, по крайней мере, удовлетворительного способа введения генных конструкций в организм.
Проще всего обстоит дело с вирусными векторами, которые, подобно их вирусам-прародителям, распространяются в организме и проникают в клетки. Такие конструкции обычно вводятся внутрисосудисто, внутрибрюшинно, подкожно или внутримышечно. Во многих случаях используются дополнительные способы повышения эффективности трансфекции, основанные на применении липосом, катионных липидов с образованием ДНК-липидных комплексов или комплексов ДНК с поликатионами (например, с полилизином).
Разработаны методы введения в организм генных конструкций, обеспечивающих трансфекцию необходимых клеточных и тканевых элементов. Эти методы в основном используются при работе с невирусными векторами, которые не обладают способностью к самостоятельному распространению в организме и проникновению в трансфицируемые клетки. Однако в некоторых случаях более эффективной оказывается "целевая доставка" генных конструкций, чтобы обеспечить (по крайней мере, до определенной степени) органную и тканевую специфичность генно-терапевтических процедур, снизить общую дозу вводимой чужеродной ДНК, повысить вероятность правильного встраивания в геном (например, при работе с ретровирусными векторами). Среди способов направленного введения генных конструкций выделим следующие.
Прямая инъекция генетического материала - самый простой метод доставки трансгена (введенного гена) в клетки in vivo, при котором ДНК вводится непосредственно в ткань путем инъекции. Область использования данного метода ограничена такими тканями, как кожа, тимус и поперечно-полосатые мышцы, некоторыми так называемыми солидными (растущими плотным узлом) опухолями, причем достаточно продолжительная (до года) экспрессия трансгена наблюдается преимущественно в мышечной ткани. Эффективность такой трансфекции обычно низкая (менее 1 %), но вполне достаточная, например, для генетической иммунизации.
Баллистическая трансфекция основана на обстреле органов и тканей микрочастицами тяжелых металлов (золото, вольфрам), покрытых плазмидной ДНК [2, с. 32]. Микрочастицы проходят через клеточные слои и переносят генетическую конструкцию непосредственно в ядра клеток. Созданная для этой цели "генная пушка" (gene gun) по своему устройству сходна со стрелковым оружием (рис. 2). Глубина проникновения микрочастиц, как правило, невелика - до 1 мм, поэтому метод используется преимущественно для трансфекции клеток кожи или подлежащего хряща. Однако при особых условиях обстрела микрочастицы могут проникать в ткань на глубину до 4-5 мм и переносить ген в волокна поперечно-полосатых мышц.
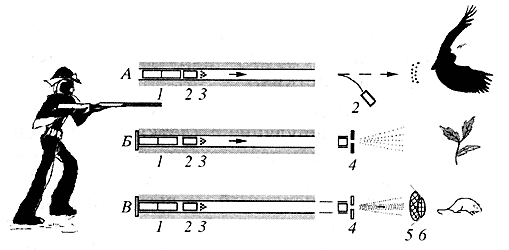
Рис. 2. Принцип конструкции ускорителя микрочастиц (генной пушки)
А - дробовое ружье: 1 - пороховой заряд, 2 - войлочный пыж, 3 - дробь;
Б - пороховой ускоритель Клейна и Стэнфорда: 1 - пороховой заряд, 2 - макроноситель (аналог пыжа), 3 - микрочастицы вольфрама, несущие вводимую ДНК, 4 - стопорная диафрагма для остановки микрочастиц:
В - ускоритель Колесникова: 1 - заряд гремучей ртути, 2 - макроноситель, 3 - смесь микрочастиц золота и вольфрама, покрытых вводимой ДНК, 4 - стопорная диафрагма для остановки микрочастиц, 5, 6 - сетчатые диафрагмы для удаления частей разрушенного макроносителя и дезинтеграции конгломерата микрочастиц соответственно
Введение генетического материала внутрь кровеносных сосудов, питающих трансфицируемый орган. Этот подход находит применение в первую очередь для лечения болезней печени.
Введение генетического материала в почку путем инъекций в питающие кровеносные сосуды, в почечную паренхиму и мочевыводящие пути.
Аэрозольное введение генетического материала в дыхательные пути используется для лечения заболеваний легких.Генная терапия ех vivo, или другими словами, генетические манипуляции с клетками, выделенными из организма, и введение их обратно в организм больного (рис. 3). Близок к генной терапии ех vivo подход, основанный на введении в организм больного клеток здорового человека или животного, содержащих нормально функционирующий ген, отсутствующий или поврежденный у пациента. Однако здесь речь идет, скорее, не о генной, а о клеточной терапии, или трансплантологии.
ЧТО ЛЕЧИТЬ?
Болезни - объекты генной терапии - могут быть разделены на две группы: наследственные и приобретенные.
Наследственные заболевания считались основными объектами генной терапии на начальном этапе ее развития. Это, как правило, моногенные заболевания, вызванные отсутствием или недостаточной функцией одного конкретного гена. Предполагалось, что введение такому больному нормально функционирующего гена приведет к излечению болезни.
Всем хорошо известна так называемая царская болезнь - гемофилия. В основе заболевания лежит дефект в генах VIII или IX фактора свертывания крови (гемофилия типа А или типа Б). Гены этих белков выделены и отсеквенированы, сформированы разнообразные ДНК-конструкции, содержащие эти гены, которые расположены на Х-хромосоме. Последнее обстоятельство служит причиной того, что данная болезнь передается по наследству по женской линии, но страдают ею практически только мужчины.
Для лечения гемофилий созданы ретровирусные конструкции, несущие гены факторов свертывания крови. Было показано, что они экспрессируются в фибробластах (соединительной ткани) кожи in vitro, однако при введении таких клеток в организм экспрессия оказывалась временной, что, по всей видимости, обусловлено отсутствием специфических промоторов, которые могли бы обеспечить постоянную работу трансгенов. Успех в лечении гемофилии был достигнут путем введения гена фактора IX свертывания крови; ген фактора VIII менее эффективен. Продемонстрирована продолжительная частичная коррекция гемофилии на моделях мышей и собак, и в 1999 г. начаты клинические работы по лечению гемофилии у человека [6].
Еще одно широко известное моногенное заболевание - миодистрофия Дюшенна - тоже связано с Х-хромосомой. Оно обусловлено дефектом в гене дистрофина. Больные мальчики к десятилетнему возрасту обездвиживаются и в последующее десятилетие наступает неизбежная смерть от нарастающей слабости сердечной и легочной мускулатуры [1,2].
Возможность генной терапии миодистрофий изучается уже почти 15 лет. Ген дистрофина выделен, клонирован и секвенирован, и на его базе созданы разнообразные генные конструкции. На модели мышей mdx, лишенных гена дистрофина, продемонстрирована возможность получения трансгенных животных, синтезирующих в мышцах нормальный ген, что привело к нормализации функции мышц. Описан ряд достаточно успешных попыток введения этого гена или его мини-вариантов взрослым животным, причем использовались различные подходы, включая целевую доставку путем баллистической трансфекции. В удачных случаях интродуцированный ген дистрофина экспрессировался в значительной массе мышечных волокон (до 25%). Однако генная терапия миодистрофий сталкивается с принципиальной трудностью: необходима генетическая модификация большинства (до 50%) мышечных волокон, разбросанных по всему организму, что требует узконаправленного и высокоэффективного метода переноса генов. Можно надеяться, что эта трудность будет преодолена с помощью высокоэффективных вирусных конструкций нового поколения, возможно, в комбинации с различными методами доставки, включая использование синтетических микросфер.
Основное внимание, судя по числу клинических протоколов, генная терапия моногенных заболеваний уделяет лечению муковисцедоза. Эта болезнь, поражающая примерно одного из 2500 новорожденных в Центральной Европе, вызывается наследственным дефектом гена, ответственного за перенос ионов через клеточную мембрану. Наличие двух дефектных аллелей гена приводит к развитию хронических легочных инфекций и неспособности нормально адсорбировать питательные вещества из пищеварительного тракта. Введение в дефектные клетки in vivo нормального гена муковисцедоза с помощью рекомбинантных аденовирусных векторов или липосом позволяет корректировать биохимический дефект без существенной токсичности. Уже начаты испытания этого подхода. Ген в легкие пациента вводится при вдыхании водно-эмульсионного препарата. Правда, на первом этапе испытания не дали положительного результата, однако применение липосом и катионных липидов дает надежду на успех.
В литературе есть данные о разработке экспериментальных подходов и проведении предклинических и клинических испытаний методов генной терапии почти 30 моногенных заболеваний человека. Однако ситуация с их лечением оказалась очень сложной и реальный лечебный эффект в большинстве случаев не достигнут. Причины тому - отторжение чужеродных генов, вызванное прежде всего иммунной реакцией организма, затухание функции трансгена, необходимость его встраивания в клеточную ДНК, причем в нужное место за счет так называемой гомологической рекомбинации, что сейчас практически недостижимо. Следует упомянуть и недостаточно высокую эффективность трансфекции, которая мешает достижению терапевтического эффекта необходимой интенсивности. В результате моногенным заболеваниям посвящено менее 10% общего числа протоколов генной терапии, а основное место в них занимают ненаследственные заболевания.
Ненаследственные заболевания не связаны с врожденным дефектом в структуре и функции одного определенного гена. Генная терапия этих заболеваний базируется на предположении, что введенный в организм "лечебный ген" приводит к синтезу белка, оказывающего терапевтический эффект. Альтернативная схема основана на изменении свойств трансфицированных клеток, что вызывает лечебный эффект сам по себе или же делает эти клетки чувствительными к действию лекарственных препаратов.
Перечень наиболее распространенных приобретенных заболеваний - объектов генной терапии - насчитывает, по крайней мере, три десятка [1, 2]. Рассмотрим несколько конкретных примеров.
Сердечно-сосудистая система. Эта быстро растущая область генной терапии развивается в нескольких направлениях [1, 2].
Первое - предотвращение тромбообразования. Основная идея - генетическая модификация эндотелия кровеносных сосудов под действием генов, продукты которых могут предотвращать формирование тромбов (например, ген тканевого активатора плазминогена). К сосудистому эндотелию гены можно доставлять через катетер, введенный в кровеносный сосуд.
Второе направление - восстановление сосудистой системы сердечной мышцы после инфаркта миокарда путем введения генов, продукты которых индуцируют процесс сосудообразования (гены ангиогенеза). И наконец, профилактика и лечение атеросклероза благодаря введению генов, ответственных за синтез липопротеидов высокой плотности, которые необходимы для нормального процесса обмена жировых компонентов крови. Разрабатывается также генно-терапевтический подход к лечению атеросклеротических изменений сосудов путем предотвращения разрастания и миграции гладкомышечных клеток сосудистой стенки. С этой целью в них вводятся соответствующие гены - супрессоры пролиферации.
ВИЧ-инфекция. Обсуждается ряд подходов, один из которых основан на модификации генома Т-лимфоцитов и макрофагов под действием "доминантного негативного" гена revMIO, продукт экспрессии которого инактивирует функциональную матричную РНК вируса иммунодефицита. Предлагается также вводить антисмысловые конструкции, чтобы блокировать экспрессию генов тех или иных белков ВИЧ. Скептическое отношение к использованию генной терапии для лечения СПИДа, вызванное отсутствием способов полного подавления ВИЧ-инфекции в культуре ткани, сменяется умеренным оптимизмом.
Артриты. Лечение заболеваний суставов (ревматоидных артритов), по всей видимости, перспективная область генной терапии. В сустав вводят гены, продукты которых оказывают лечебный эффект, в частности, ген, кодирующий белок-антагонист рецептора интерлейкина-1. Ген клеточного старения используется для предотвращения избыточной пролиферации синовиальных клеток, покрывающих суставную сумку [7]. Еще один лечебный подход предусматривает доставку в суставную сумку антисмысловой конструкции, которая направлена на подавление синтеза белка FcappaB - одного из важнейших факторов воспаления [8].
ДНК-иммунизация. Этот подход относится не только к генной терапии, но и к ее ветви - генной профилактике. В организм вводятся генные конструкции, кодирующие белки, к которым необходимо получить иммунный ответ. В случае эффективной экспрессии генов эти белки служат антигенами для развития иммунного ответа. В первых работах иммунизацию проводили с помощью подкожной или внутримышечной инъекции ДНК. Однако практически сразу с этой целью начали использовать баллистическую трансфекцию, которая оказалась очень эффективной, по всей видимости, вследствие множественности мест взаимодействия трансгена с тканями.
Метод генной иммунизации, часто называемой ДНК-вакцинацией, подробно разработанный в опытах на животных, показал высокую эффективность, особенно в отношении вирусных инфекций - клещевого энцефалита, СПИДа и некоторых других. Из последних достижений следует упомянуть попытку создания ДНК-вакцины против малярии. Иммунный эффект достигался путем введения в мышцу "голой" ДНК [9].
ДНК-иммунизация имеет ряд преимуществ по сравнению с обычной вакцинацией. Один рекомбинантный (составленный из нескольких генов) вектор может направлять синтез нескольких антигенов одновременно, что уменьшает число отдельных иммунизаций. При этом снимаются проблемы, связанные с трудностями проникновения в организм белка, и значительно снижается риск побочных эффектов, которые зависят от токсичности вводимых при обычной иммунизации балластных белков или вирулентности используемых бактерий и вирусов. Можно ожидать, что в ближайшие годы именно ДНК-иммунизация окажется в числе наиболее эффективных методов генной терапии.
Заболевания кожи. Несомненный интерес представляют исследования по генной терапии кожного эпителия. Прямое втирание ДНК в волосяные фолликулы открывает эффективный и нетравматический путь для доставки в организм генетических конструкций. Разработан генно-терапевтический подход, основанный на подсадке в кожу трансформированных in vitro клеток кожного эпителия (кератиноцитов). Ранее было продемонстрировано, что введение с помощью генной пушки плазмиды, несущей ген фактора роста эпителия, ускоряет заживление кожных ран.
Теломеризация клеток. Это направление генной терапии находится в самом начале своего развития, поскольку лишь недавно был обнаружен феномен "обессмерчивания" клеток. Известно, что большинство клеток взрослого организма способно при делении только на определенное число удвоений, что связано с происходящим при каждом делении укорачивании ДНК в концевых участках хромосом - теломерах. Введение в клетки гена теломеразы - фермента, который может удлинять теломеры, приводит к тому, что растущие вне организма клетки, по крайней мере из соединительной ткани (фибробласты), могут делиться бесконечно долго.
В двух работах, опубликованных в 2000 г., сообщается о попытках использования гена теломеразы в генной терапии. В частности, мышам с экспериментальным циррозом печени вводился ген теломеразы, после чего у них появлялась теломеразная активность в клетках печени. Между тем, в норме эта активность не наблюдалась. По мнению авторов, теломеризация клеток печени может способствовать восстановлению нормального содержания гепатоцитов, а следовательно, лечению цирроза [10]. Другой пример. Мышам с удаленными надпочечниками вводились теломеризованные клетки этого органа, что привело к обеспечению его функции [11]. Высказано предположение, что использование "обессмерченных" клеток окажется полезным для создания искусственных органов, выращенных из клеток пациента и поэтому не отторгающихся при трансплантации.
Несмотря на то, что круг ненаследственных заболеваний, лечением которых занимается генная терапия, очень широк, до 80% всех современных протоколов генной терапии приходится на опухолевые заболевания.
Опухолевые заболевания. Естественно возникает вопрос: почему генная терапия опухолей получила такое распространение? Прежде всего из-за огромного множества раковых заболеваний, их необратимости при отсутствии лечения и сложности, а часто и невозможности проведения соответствующей терапии. Но есть и вторая группа причин: в отношении тяжелых, часто безнадежных раковых больных утрачивают свое значение такие соображения, как отдаленный риск генетических повреждений. Ведь для лечения этих больных используются такие безусловно опасные средства, как массированное облучение организма, введение в огромных дозах чрезвычайно токсичных химических веществ или хирургическое удаление жизненно важных органов.
Перечислим основные методы генной терапии опухолей:
• усиление иммуногенности опухоли;Рассмотрим подробнее один из этих подходов, например, повышение чувствительности опухолевых клеток к химиотерапевтическим препаратам. В них вводят гены, кодирующие ферменты, которые способны переводить химическое соединение из слаботоксичной в высокотоксичную форму. Обычно для этой цели используют тимидинкиназу вируса простого герпеса (HSV-TK). Этот ген избирательно фосфорилирует синтетический нуклеозидный аналог ганцикловир, при дальнейшем фосфорилировании которого другими ферментами образуется эффективный ингибитор синтеза ДНК. Интересно, что ганцикловир вызывает регрессию уже существующей у животного обычной опухоли, если рядом с ней ввести определенное количество опухолевых клеток, содержащих ген HSV-TK. Это явление, получившее название "эффекта присутствия" (bystander effect), видимо, опосредуется иммунными механизмами.• генетическая модификация клеток иммунной системы для усиления их противоопухолевой активности;
• введение в опухоль генов чувствительности к химиотерапевтическим препаратам ("генов самоубийства");
• блокирование экспрессии онкогенов (например, с помощью антисенсовых конструкций или внутриклеточных антител);
• введение в раковые клетки гена-супрессора опухолевого роста, например, гена белка р53 ("дикого" типа);
• блокировка экспрессии генов пролиферации (онкогенов);
• защита нормальных тканей от системного токсического действия химиотерапии (например, введение в стволовые клетки костного мозга гена множественной лекарственной устойчивости);
• повышение устойчивости к облучению клеток нормальных тканей, находящихся рядом с опухолью, за счет сверхэкспрессии в них антиоксидантов (например, глутатион-синтетазы или трансферазы);
• создание и использование рекомбинантных генных противоопухолевых вакцин.
Данный метод генной терапии опухолей интенсивно развивается, ведутся клинические испытания на пациентах, в частности с плевральной мезотелиомой, раком яичников и опухолью мозга глиобластомой. В 1999 г. был одобрен протокол лечения рака предстательной железы. В железу инъецируется генная конструкция, содержащая ген HSV-TK, а в кровь больного вводится ганцикловир. Подобраны безопасные дозы и продемонстрирован положительный лечебный эффект [2, с. 127].
ГЕНЕТИЧЕСКАЯ БЕЗОПАСНОСТЬ И ЭТИЧЕСКИЕ АСПЕКТЫ
Естественно, что все процедуры генной терапии, начиная с создания векторных конструкций и кончая их доставкой в организм больного, должны строго подчиняться общепринятым правилам безопасности, выработанным для генной инженерии. Однако проведение генетических манипуляций применительно к организму человека предъявляет особые требования к их безопасности. Дело в том, что любое введение в клетки организма человека генных конструкций, с какой бы целью оно не производилось, может иметь отрицательные последствия. Неконтролируемое встраивание в те или другие участки генома способно привести к нарушению функции любых генов, в том числе регулирующих клеточное размножение и иммунные реакции. Это может, в свою очередь, вызвать крайне нежелательные изменения в организме, включая образование раковых опухолей.
Возможный негативный эффект генетического воздействия потенциально несоизмерим при трансфекции или генетической трансформации соматических (клеток тела) и половых клеток. В первом случае речь идет о судьбе одного индивида, как правило, тяжело или смертельно больного. Здесь риск, связанный с лечебными процедурами, обычно значительно меньше, чем риск смертельного исхода от первичного заболевания (например, рака на поздней стадии развития). Степень генетического риска при соматической генной терапии к тому же резко снижается, если используются конструкции, не обладающие способностью встраиваться в геном клетки-реципиента, в частности, векторы, создаваемые на базе аденовирусов и вируса простого герпеса.
В то же время введение генных конструкций в половые клетки может вызвать нежелательные изменения в геноме будущих поколений или, в широком смысле слова, - генофонде человечества. Поэтому естественно стремление запретить такие исследования не только из медицинских, но и сугубо этических соображений, поскольку здесь генная терапия смыкается с евгеникой.
Однако утверждение о безусловном запрещении введения генных конструкций в половые клетки начинает приобретать менее категорический характер, чем это было всего несколько лет назад. В частности, разрабатываются подходы к генному вмешательству, правда, и не в половые клетки, но в клетки развивающегося эмбриона человека, то есть внутриматочная генная терапия, как говорят, генная терапия in utero. Разрешение на такое вмешательство дано в 1998 г. в США Комитетом по рекомбинантным молекулам, регулирующим все генно-инженерные манипуляции в стране [12].
Были выбраны два тяжелейших генетических недуга: жестокий комбинированный иммунодефицит, вызываемый дефектом в гене фермента аденозиндезаминазы (ADA), и гомозиготная бета-талассемия - тяжелое наследственное заболевание, связанное с отсутствием всех четырех глобиновых генов или мутациями в них. Уже имеются генные конструкции, доставка которых в организм, как предполагается, приведет к компенсации генетических дефектов и ликвидации проявлений обеих этих болезней. В предложенном протоколе намечено проведение лишь предварительных исследований на развивающихся эмбрионах человека. Схема протокола такова:
• установление с помощью пренатальной (дородовой) диагностики наличия у плода на ранней стадии беременности одного из указанных заболеваний в форме, являющейся безусловным медицинским показанием для прерывания беременности;Очевидно, что предложенные процедуры не являются прямыми попытками генной терапии человека, это лишь приближение к таковой. Однако сам факт представления подобных проектов и их одобрение знаменует существенный сдвиг во взглядах международной научной общественности на проведение генетических манипуляций на эмбриональных клетках человека. О явно проявляющейся тенденции ослабить требования к генетическим манипуляциям на половых клетках человека свидетельствуют сообщения в прессе, опубликованные в январе 2001 г., о начале опытов по клонированию человека в США и разрешении британской палаты лордов на выращивание так называемых стволовых клеток эмбриона человека.• введение в ткани плода соответствующей генетической конструкции;
• осуществление через определенный промежуток времени, в течение которого плод продолжает развиваться в чреве матери, искусственного прерывания беременности;
• детальное эмбриологическое и молекулярно-генетическое исследование абортного материала.
Генетическое исправление наследственных дефектов эмбриона может осуществляться только с помощью встраивающихся в геном конструкций, что грозит потомству потенциальной возможностью возникновения отрицательных генетических последствий. Поэтому кажется разумным запрет на внутриматочную генную терапию, но возникающие здесь морально-этические проблемы не имеют однозначного решения.
Рассмотрим гипотетическую ситуацию. Пренатальная диагностика эмбриона на ранней стадии развития выявила тяжелый генетический дефект, поддающийся успешной внутриматочной генной терапии. Какой медицинский совет можно дать будущим родителям?
Сохранить плод, вылечив ребенка, но подвергнуть потенциальному, хотя и недоказанному генетическому риску его потомство? Или искусственно прервать беременность, как это обычно рекомендуется в настоящее время при установлении тяжелого неизлечимого наследственного заболевания плода? Разумным представляется второе решение. Однако нет никакой уверенности, что с ним согласятся, например, представители католической церкви.
Считаю нужным упомянуть о возможной опасности генной терапии для окружающих. Векторные конструкции создаются на базе различных вирусов, чаще ретровирусов. Разумеется, при конструировании таких векторов принимаются специальные меры, лишающие их инфекционных свойств, однако потенциальная опасность работы с вирусами должна неизменно находиться в поле зрения контролирующих органов.
Во второй половине 1999 г. пристальное внимание медицинской и биологической общественности привлек случай смерти больного, подвергшегося генно-терапевтическому лечению. Этот случай произошел в Пенсильванском университете в США. Восемнадцатилетнему больному, страдавшему редким тяжелейшим генетическим заболеванием - недостаточностью по гену орнитин-трансаминазы, была введена с лечебной целью генная конструкция в составе аденовирусного вектора. Через несколько часов у больного поднялась температура, наступил общий тромбоз сосудов и вскоре больной скончался. Это событие привело если не к полному запрету, то, во всяком случае, к временному свертыванию клинических испытаний. Однако некоторое время спустя установили, что причиной несчастья было медицинское осложнение неизвестной природы, а не специфическое последствие генной терапии [13]. Ныне клинические испытания генно-терапевтических протоколов ведутся во все возрастающем масштабе: на конец 1999 г. зарегистрировано 332 протокола генной терапии только из учреждений США [14].
МЕСТО РОССИЙСКОЙ НАУКИ
За короткий срок генной терапией пройден огромный путь, накоплены впечатляющие по объему сведения, в нее вложены колоссальные средства. В то же время реальные результаты генной терапии достаточно скромны - они неизмеримо меньше того, что можно было бы ожидать, исходя из вложенных средств. Романтические ожидания - "Вот выделим нужные гены, научимся их правильно вводить и основные проблемы медицины, по крайней мере, в отношении наследственных заболеваний, будут решены" - оказались, увы, чрезвычайно далекими от реальности. Регуляторные системы организма настолько сложны и так мало изучены, что простое введение гена в большинстве случаев не оказывает необходимого лечебного эффекта.
Как это неоднократно бывало в истории человечества, на смену романтике пришел прагматический реализм. Именно в этом трудном периоде находится сейчас генная терапия. Она не стала и, по-видимому, никогда не станет панацеей. Такой взгляд на современное состояние генной терапии нашел отражение в заглавии статьи К. Синиора "Генная терапия: тернистый путь в третье тысячелетие", опубликованной в 2000 г. в журнале "Молекулярная медицина сегодня" [4]. Однако есть основания полагать, что накопленный огромный материал и созданные и создаваемые принципиально новые технологии все чаще будут приводить к конкретным, сначала небольшим, а потом и серьезным успехам в лечении все увеличивающегося числа заболеваний человека. В конце концов генная терапия войдет в разряд важных, а может быть, и важнейших подходов практической медицины. С этих позиций и следует оценивать положение отечественной науки.
Часто, до боли часто, приходится нам говорить об отставании нашей науки и отдельных ее разделов от общего фронта исследований в мире. В полной мере это относится к генной терапии. Причины тому очевидны: генная терапия - высокотехнологичная наука, требующая огромных затрат, а основное ее развитие выпало на последнее десятилетие, когда резко сократилось финансирование науки в России. И хотя некоторые попытки генно-терапевтических исследований в нашей стране делаются [2], надо, безусловно, признать, что наш вклад в общее развитие этого направления биомедицины исчезающе мал.
И все же наличие нескольких квалифицированных, неплохо оснащенных исследовательских групп, работающих в области генной терапии, позволяет нашим ученым быть достаточно ориентированными в главных направлениях данной области мировой науки, ее основных тенденциях и достижениях. Это дает основание надеяться, что наша биология и медицина не пропустят того момента, когда развитие генной терапии приведет к созданию высокоэффективных методов лечения, и быстро внедрят их в практику отечественного здравоохранения. Разумеется, это не произойдет само собой, а потребует целевого вложения значительных средств для поддержания проводимых в стране исследований на уровне передовых лабораторий мира.
Литература
1. Culver K.W. Gene Therapy. A Handbook for Physicians. 2nd Edition NY: Mary Ann Liebert Inc. Publishers, 1996.
2. Генная терапия - медицина будущего / Редактор-составитель А.В. Зеленин. М.: ВИНИТИ РАН-ППФНТП "Геном человека", 2000.
3. Wolff J.A., Lederberg L. A history of gene transfer and therapy // Gene therapeutics. Methods and applications of direct gene transfer / Ed. J.A. Wolif. Boston-Basel-Berlin: Birkhauser, 1994. P. 3-25.
4. Senior К. Gene therapy: a rocky start to the new millennium // Molecular Medicine Today. 2000. V. 6. P. 93.
5. Agrawal S., Kandimalla E.R. Antisence therapeutics: is it as simple as complemenatary base recognition // Molecular Medicine Today. 2000. V. 6. P. 72-81.
6. Kaufman R.J. Advances toward gene therapy for hemo-philia at the millennium // Hum. Gene Ther. 1999. V. 10. P. 2091-2107.
7. Taniguchi К., Kohsaka H., lnone N. et al. Induction of the p16INK4a senescence gene as a new therapeutic strategy for the treatment of rheumatoid arthritis // Nature Medicine. 1999. V. 5. P. 760-767.
8. Makarov A.V., Kovalenko D.V., Brown C.E. et al. NF-kappaB activation provides the potential link between inflammation and hyperplasia in the arthritic joint // Proc. Nat. Acad. Sci. 1998. V. 95. P. 13959-13864,
9. Martin Т., Parker S.E., Hedstrom R. et al. Plasmid DNA malaria vaccine: the potential for genome integration after intramuscular injection // Hum. Gene Ther. 1999. V. 10. P. 759-768.
10. Rudoph К .L., Chang S., Millard М. et al. Inhibition of experimental liver cirrhosis in mice by telomerase gene delivery // Science. 2000. V. 287. P. 1253-1258.
11. Thomas М.. Yang L., Homsby PJ. Formation of functional tissue from transplanted adrenocortical cells expressing telomerase reverse transcriptase // Nature Biotechnology. 2000. V. 18. P. 39-42.
12. Zanjani E.D., Abderson W.E. Prospects for in utero gene therapy // Science. 1999. V. 285. P. 2084-2088.
13. Virus teatment questioned after gene theapy death // Nature. 1999. V. 401. P. 517.
14. Human Gene Markers / Therapy Clinical Protocols // Hum. Gene Ther. 1999. V. 10. P. 3067-3118.
Июль 2001 |