том 73, № 6, с. 496-513 (2003)
| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
том 73, № 6, с. 496-513 (2003) |
К 50-ЛЕТИЮ ОТКРЫТИЯ СТРУКТУРЫ ДНК
|
Л.Л. Киселев, "Юбилей самой главной молекулы"
Е. Д. Свердлов, "Великое открытие: революция, канонизация, догмы и ересь" В. Л. Карпов, "ДНК, хроматин, гистоновый код" |
Л.Л. Киселев,
академикАпрель 2003 г. - особый месяц в истории мировой науки. Исполняется 50 лет с момента публикации в журнале "Nature" статьи "Структура дезоксирибонуклеиновой кислоты" Джеймса Уотсона и Фрэнсиса Крика, где впервые была предложена модель пространственной структуры ДНК - знаменитая двойная спираль. Удивительным образом это двойной юбилей: 6 апреля исполняется 75 лет одному из отцов двойной спирали - Дж. Уотсону.
С апреля 1953 г. биология ведет новый отсчет времени, с этого момента берет начало новая биология. Почему же открытие пространственной структуры всего лишь одной молекулы - ДНК - стало переломным моментом, привело к революционным изменениям в биологии?
К началу 1950-х годов уже было известно, что ДНК - это материальный носитель информации о наследуемых свойствах живых организмов, носитель наследственности. Однако оставалось непонятным, как этот гетерополимер, состоящий из четырех разных мономерных звеньев, может осуществлять две свои главные функции: передавать информацию потомству, то есть дочерним клеткам, и реализовать информацию внутри клетки.
Двойная спираль немедленно породила прямое следствие из собственной структуры - модель репликации (размножения) ДНК путем расхождения двух цепей, образующих двойную спираль, и построение по каждой из цепей комплементарной (дополнительной) нити. Очевидно, что таким элементарно простым способом можно из одной двойной спирали получить две идентичные двойные спирали, то есть удвоить молекулу ДНК, что и требуется при размножении клеток и организмов. Процесс репликации, как мы теперь знаем, у высших организмов очень сложен, но в его основе лежит именно расхождение двух комплементарных нитей и построение по каждой из них новой, дополняющей нити.
Что касается реализации заложенной в ДНК информации, то очень скоро стало ясно, что здесь работает тот же матричный принцип, на котором основана репликация: по одной из нитей ДНК строится вторая, комплементарная нить другой нуклеиновой кислоты - рибонуклеиновой (РНК), которая химически очень близка к ДНК, а уже эта РНК после ряда преобразований становится матрицей для синтеза молекул белков - конечного звена реализации генетической информации.
Апрель 1953 г. положил начало бурному, до сих пор не прекращающемуся развитию молекулярной биологии, и на этом пути была сделана серия блестящих открытий, большинство из которых отмечено Нобелевскими премиями.
Сейчас, спустя 50 лет, нам ясно, что открытие структуры ДНК стало возможным благодаря глубокому взаимодействию основных естественно-научных дисциплин - физики, химии и биологии. Микробиологи открыли серологическую трансформацию бактерий, что позволило биохимикам установить химическую природу вещества наследственности, а это, в свою очередь, позволило открыть двойную спираль физическим методом, опираясь на химические и биохимические свойства ДНК. Сейчас к этой триаде наук, сформировавших молекулярную биологию, присоединилась еще одна наука - биоинформатика, пограничная между математикой и новой биологией.
На рубеже веков от пространственной структуры ДНК (двойная спираль) был совершен еще один гигантский скачок: раскрыта первичная структура ДНК сотен организмов - от многочисленных бактерий до человека. Это породило новую науку - геномику - учение о строении и функциях геномов живых организмов, то есть о том, как преобразуется информация, записанная в ДНК, в строение и свойства живых существ.
Геномика - прямое порождение двойной спирали, хотя и отодвинутое во времени на несколько десятилетий. Появление этой дисциплины, пограничной между молекулярной биологией, генетикой и биоинформатикой, -знаковое событие исхода прошлого века. В отличие от классической молекулярной биологии, геномика имеет колоссальный диапазон воздействия и на сопредельные науки, и на общество в целом. Прежде всего геномика - основа биотехнологии, самой передовой отрасли современной промышленности. Геномика - основа молекулярной диагностики огромного числа наследственных заболеваний, она позволяет прогнозировать риск развития многих тяжелейших болезней у пациентов, помогает конструировать лекарства на рациональной структурно-химической основе. Геномика создала абсолютно новые возможности изучения эволюции живых организмов - вечной и пока не решенной проблемы биологии. Геномика по-новому поставила проблему происхождения человека и его эволюции. Этногеномика сумела доказать, что человек произошел из Африки, удалось открыть ДНК-маркеры, отличающие разные этнические группы, расы и народности, что стало совершенно новым вкладом в историю человечества, в этнографию, лингвистику, палеонтологию и археологию. Этногеномика - мост между естественными и гуманитарными науками, качественно новое явление в познании мира.
ДНК-маркеры позволяют отличить одного человека от другого, только пользуясь его генетическим материалом. Это стало основой уже сложившегося нового направления, которое можно назвать "молекулярной криминалистикой". Сейчас на доказательство принадлежности конкретного ребенка отцу или матери (или наоборот) уходит день-два, и делается это с абсолютной надежностью. Идентификация личности при катастрофах, войнах и буйствах стихии - самая надежная по ДНК-маркерам.
Журнал до конца года планирует публикацию серии статей ведущих российских ученых, в которых будут раскрыты с разных сторон значение и роль ДНК в современной науке. Это не исторические очерки, а слепки с состояния данной проблемы на начало текущего века. Эти статьи призваны показать, что сейчас царица молекул - ДНК - стала мотором развития новых наук и определяет будущее здравоохранения, медицины, биотехнологии, производства продуктов питания и многого-многого другого. Уверен, что тот, кто прочтет эти статьи, согласится, что биология, действительно, лидер естествознания XXI века.
ВЕЛИКОЕ ОТКРЫТИЕ:
РЕВОЛЮЦИЯ, КАНОНИЗАЦИЯ, ДОГМЫ И ЕРЕСЬЕ. Д. Свердлов
Свердлов Евгений Давидович - академик, директор Института молекулярной генетики РАН.
25 апреля 1953 г. в скромном двухстраничном письме в "Nature" Джеймс Уотсон и Фрэнсис Крик сформулировали открытие, которое инициировало целую эпоху исследований в области наук о жизни. Это было открытие двойной спиральной структуры соли выделенной и очищенной ДНК. Статья и начинается словами: "Мы хотим предложить структуру соли дезоксирибонуклеиновой кислоты (Д.Н.К.). Эта структура имеет новые особенности, которые представляют значительный интерес для биологии" [1]. Я не буду говорить о том, что их открытие было подготовлено многими предыдущими исследованиями, что оно объяснило принципы функционирования генов, что оно создало основу молекулярных подходов в генетике и т.д., - этому посвящены тома литературы, а в моем распоряжении несколько страниц журнального текста. Поэтому я сразу сформулирую то, о чем хотел бы сказать в этой своей статье.
Двуспиральная ДНК, дав громадный импульс развитию биологии, стала иконой не только в учебниках по биологии, но и в искусстве, архитектуре, рекламе и символике различных конференций, конгрессов, съездов, так или иначе связанных с проблемами жизни. Об этом замечательно написал М. Кемп в статье "Мона Лиза современной науки", опубликованной журналом "Nature" 23 января 2003 г. (этот номер журнала посвящен открытию ДНК):
"Нет другой молекулы в истории науки, которая достигла бы иконного статуса ДНК... История породила всего несколько суперимиджей, которые настолько пронизали наше ... сознание, что они далеко превзошли свое первоначальное содержание (context). Это символизировано Моной Лизой, изображенной Леонардо да Винчи примерно в 1503 году. Двойная спираль ДНК не имеет равных в качестве символа биологических наук. Оба символа говорят публике много больше, чем об их узкоспециализированном мире, и оба несут громадный багаж ассоциаций" [2].Или вот что говорит один из гигантов, заложивших реальную основу для окрытия структуры ДНК, Е. Чаргаф:"...выдающийся харизматический символ нашего времени - спиральная лестница, ведущая, я надеюсь, в небеса, - была разрекламирована с поистине выдающейся интенсивностью. Она использовалась как эмблема, ее рисовали на галстуках, она украшала фирменные бланки, ее устанавливали перед зданиями.... Она даже вторглась в высокие формы изящного искусства" [3].Как всякая икона, ДНК зачаровывает и вводит в заблуждение. Все внимание сосредоточивается на спиральности и симметрии. Появилась целая наука (условно я назову ее ДНКлогия), которая занялась всецело свойствами этой спирали в самых разных условиях. Сотни статей посвящены уточнению параметров спирали. Каждый уважающий себя молекулярный биолог вызубривал, чем отличается А-форма ДНК от В-формы и посвящал массу сил запоминанию расстояний между парами оснований, наклону плоскостей этих пар относительно оси спирали и проч. и проч. и проч. Чтобы не критиковать других, сошлюсь на себя.Вот как я описывал ДНК в книге "Органическая химия нуклеиновых кислот":
"Форма А представляет собой истинную кристаллическую форму соли ДНК, которая образуется при относительной влажности препарата ниже 80%. На один виток спирали в этой форме приходится 11 оснований, которые отклонены на угол 20° от перпендикуляра к оси спирали. Расстояние между основаниями составляет 2.56 А и угол вращения 32.7°. Плоскости двух оснований, составляющих пару, не компланарны, и двугранный угол между ними составляет 16°. Молекула имеет ось симметрии второго порядка, перпендикулярную оси спирали, следовательно, две составляющие двойную спираль цепи имеют противоположное направление. Форма А представляет собой правовращающую спираль, построение левовинтовой спирали для нее невозможно.И далее я еще рассказывал о форме С, которая является наименее влажной из всех трех форм.Форма В существует при относительной влажности >80% и является паракристаллической формой. В свете последних данных форма В все-таки может быть построена в виде левовинтовой спирали. Однако поскольку формы А и В легко превращаются друг в друга, то из правовинтового характера формы А следует такая же направленность спирали в форме В.
Форма В играет особо важную роль, поскольку, по-видимому, она является той формой, в которой ДНК существует в водном растворе. В последующих работах по исследованию формы В был уточнен ряд параметров, данных Уотсоном и Криком. В частности, диаметр спирали оказался равным 18 А, основания размещены ближе к оси спирали, углеводные остатки значительно отклонены от оси спирали. Однако основные положения гипотезы Уотсона и Крика остались без изменения".
Образовалось обширное поле деятельности для физики биополимеров, но в итоге за великолепной симметричной двуспиральностью (а и б на рис.), очень хорошо подходящей для символики и искусства, как-то затерялась двухцепочечность и комплементарность (в на рис.) - именно та суть, та квинтэссенция, которая была, есть и будет основой функционирования генов и геномов. По-видимому, это было неизбежно: как искусство прошло через стадию иконописи к реализму, так и наука должна была узнать все про выделенную ДНК на пути к пониманию, что и как она делает в клетке, становясь компонентом сложнейшей системы взаимодействий, в которые вовлечен геном.
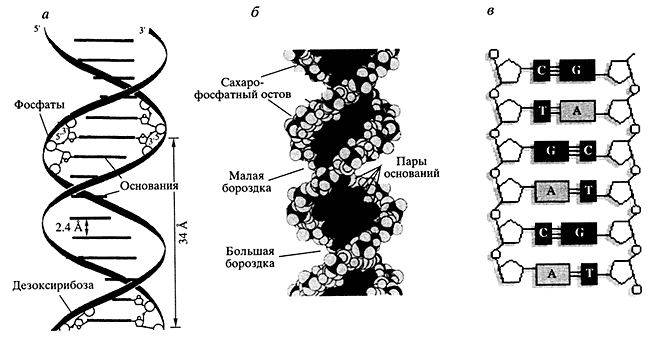
Три представления ДНКа и б - классические изображения двуспиральной ДНК; в - ДНК как двухцепочечная структура с неопределенными физическими параметрами, но с цепями, комплементарными друг другу; А, С, G, Т- мономерные звенья полимерной молекулы ДНК; C-G, Т-А -комплементарные пары оснований, связывающие две цепиВ клетке, где ДНК реально существует и функционирует, исчезает все это великолепие художественной совершенности. Исчезает А, исчезает В и появляется нечто такое, что до сих пор не удается понять до конца. Сошлюсь на статью П. Болла в том же январском номере "Nature" за 2003 г.:"Двойная спираль идеализирована в силу ее эстетичной элегантной структуры, но не реального физического существования ДНК. Большая часть ДНК в клетке сжата в сложный клубок, который каким-то образом все-таки вовлекается в тщательный контроль регуляции генов... Хотя в эти постгеномные дни модно показывать ДНК как бесконечную последовательность А, G, С и Т, эта годовщина будет изобиловать двумя типами представлений о ДНК. Одно будет показывать знаменитую двойную спираль...Более того, все записано не просто на страницах этой книги. Функционирование ДНК зависит от многоступенчатой передачи информации разного рода. Оно не самым простым образом связано с ее последовательностью.Другое будет показывать Х-образные символы наследственности - хромосомы. И не надо думать, что этот клубок может быть понят на основе идеальной двойной спирали. Эти нити представляют собой комплексы ДНК с белками -хроматин, в которых только очень короткие фрагменты нативной спирали могут временно появляться. Хотя хромосомы часто приравнивают к ДНК, не надо забывать, что в них белка в два раза больше, чем ДНК. И, кроме того, там еще содержится 10% РНК, которая синтезируется в процессе транскрипции... Учебники, понятно почему, рассматривают процесс репликации ДНК как систематическое движение ДНК-полимеразы (ДНК-синтезирующего фермента) вдоль одной линейной цепи ДНК, выстроенной подобно линии железной дороги. То же самое относится и к транскрипции, осуществляемой РНК-полимеразой. Создается впечатление, что геном - это открытая книга, готовая для чтения. Однако это не так. Книга закрыта, запечатана и запакована" [4].
Здесь мы имеем дело со второй канонизированной догмой, особенно распространенной среди непрофессионалов: все свойства клетки и даже многоклеточного организма однозначно записаны в последовательности ДНК. Это не менее все-проникающее убеждение, чем представление о ДНК в организме как двойной спирали. И если раньше ересью было бы сказать, что двойная спираль - это только идеализированная икона, то теперь, пожалуй, еще большей ересью представляется утверждение, что, возможно и, более того, весьма вероятно, не все свойства организма определяются последовательностью ДНК. И предстоит еще очень большая работа по пониманию того, как последовательность генома влияет на функции организма.
Наконец, и самое главное. Увлекшись структурой ДНК, молекулярно-биологический мир как-то забыл, что главный вопрос, на который он хотел бы, более того, должен был бы ответить, - это вопрос, задаваемый всеми поколениями мыслителей: "Что такое жизнь?". Этот вопрос не об изобретении очередной красивой формулы типа "жизнь - это медленное умирание", а вопрос о механизмах, которые вызывают жизнь. И каждый ученый, занятый науками о жизни, должен определять, насколько его исследование помогает найти ответ. Открытие структуры ДНК было одним из самых крупных шагов в этом поиске. К сожалению, следует признать, что столь необходимый шаг все-таки очень недостаточен для ответа на главный вопрос о феномене жизни. Но благодаря ДНК наука получила такой импульс, что, возможно, сегодня мы можем попытаться ответить на него.
ВАЖНОСТЬ И НЕДОСТАТОЧНОСТЬ ОПРЕДЕЛЕНИЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ГЕНОМОВ
Последние несколько лет ознаменовались громадными успехами в секвенировании целых геномов различных организмов - от одноклеточных прокариот до многоклеточных животных, включая человека (табл. 1). Этот несомненно громадныи прогресс навсегда останется в числе выдающихся достижений XX столетия наряду с гигантским прорывом в космос, освоением ядерной энергии и революцией в информационных технологиях.
Сравнительный анализ полных геномов несопоставимо более информативен, чем сравнительный анализ отдельных генов, например, генов рибосомных РНК, который практиковался для заключений о взаимосвязях между организмами в догеномный период. Такой анализ позволяет делать выводы, имеющие общебиологическое значение, в частности, выводы о механизмах и темпах эволюции, вариабельности геномов, взаимоотношениях между организмами со средой их обитания.
Вот вкратце лишь некоторые итоги сравнительного анализа множества полных геномов с эволюционной точки зрения [12, 13].
Сравнение структур генов секвенированных к настоящему времени геномов человека, дрозофилы нематоды, дрожжей и бактерий приводит к выводу, что все живые существа действительно произошли от общего предшественника в результате дупликаций, модификаций и различного рода перетасовок генетического материала. Родственные гены легко идентифицируются в геномах представителей всех трех царств живых организмов. Однако существуют также гены, кодирующие продукты, специфичные для отдельных видов.
В свое время, благодаря сходству транскрипционного и трансляционного аппаратов архебактерий и эукариот, архебактерии были выделены в отдельное царство Archaebacteria (Archaea). Анализ полных геномов микроорганизмов показал, что остальные части геномов архебактерии гораздо больше похожи на эубактерии (Eubacteria, или Bacteria). Это свидетельствует в пользу того, что эукариоты появились как химеры в результате слияния эу- и архебактерии. Возможно также, что в этом слиянии участвовал третий организм, обладавший цитоскелетом, истинные гомологи компонентов которого не обнаруживаются ни в архе- ни в эубактериях.
Микробные геномы, последовательности которых установлены к сегодняшнему дню, имеют размеры от 0.6 до 4.7 Мбаз. Это является следствием чрезвычайной пластичности бактериальных геномов, которая приводит к их усложнению за счет дупликаций или к уменьшению за счет делеций, сравнительно быстро удаляющих ненужные для жизнедеятельности организма гены. В разных геномах существуют разные кластеры дуплицированных генов, например, у В. subtilis более четверти генов проявляют признаки недавней дупликаций. А хорошим примером делеций являются микоплазмы. У двух близкородственных микоплазм, имеющих самые маленькие геномы из известных пока и получающих многие необходимые продукты от хозяев, отсутствуют части геномов, которые определяют синтез ряда аминокислот, жирных кислот, нуклеотидов и ферментов цикла Кребса. Геномы подвергаются множеству разных других перегруппировок [14], хотя на них накладываются некоторые ограничения, способствующие сохранению порядка встречаемости определенных генов, вовлеченных в выполнение одной функции у разных организмов. Пластичность геномов приводит к чрезвычайной вариабельности геномов микроорганизмов.
Получила дальнейшее сильное подтверждение возможность межвидового (горизонтального) транспорта генов. В результате некоторые гены определенного вида часто оказываются более похожими по последовательности на гены представителей не просто другого вида, а даже другого царства. Возможно, благодаря межвидовому транспорту бактериальные гены обнаруживаются в геноме человека, хотя это пока нельзя считать твердо доказанным фактом [15].
Неудивительно, что самые элементарные клеточные функции, такие как базовый метаболизм, транскрипция, трансляция, репликация ДНК, остались консервативными со времени расхождения одноклеточных дрожжей и бактерий. Но консервативность распространяется на значительно большее число генов. В сумме 60% из предсказанных белков человека имеют сходство с белками других видов, геномы которых секвенированы.
Очень информативное сопоставление на пол-ногеномном уровне оперирует не целыми белками, а их дискретными, структурными единицами - доменами (модулями). Оказалось, что лишь сравнительно небольшая пропорция разных идентифицированных доменов появилась в линии позвоночных. Большинство белковых доменов прослеживается до общего предка животных. Упомянутые "позвоночно-специфичные" семейства включают защитные белки и белки иммунной системы, а также белки, функционирующие в нервной системе. Они возникли недавно в эволюции и/или были объектами быстрой дивергенции. Эти белки определяют значительные физиологические различия между позвоночными и другими эукариотами.
Самое явственное различие между человеком и мышью и другими организмами с секвенированными геномами состоит в том, что белки человека содержат больше доменов на белок и новые комбинации доменов. Таким образом, архитектура доменов, определяемая как линейное распределение доменов в полипептиде, формировалась в ходе эволюции. Новые доменные архитектуры создавались перетасовкой доменов, их добавлением или устранением из уже существующих архитектур.
Сравнение полногеномных последовательностей дало возможность поставить вопросы о минимальном числе генов, достаточном для жизнедеятельности простой клетки и о возможном числе генов у общего предшественника современных микроорганизмов. Об этом речь впереди.
Доступность полногеномных последовательностей в сочетании с современными интенсивными методами одновременного анализа экспрессии множества генов позволила впервые начать выяснение вопроса о регуляции экспрессии не отдельного гена, а генома как целого, и выявить, что множество генов группируется в ко-регули-руемые кластеры. Это приводит к гипотезе об участии генов, входящих в один кластер, в выполнении однотипных функций. Правомерной представляется гипотеза о состоящих из различных генов продуктов их экспрессии и регуляторных элементов функциональных модулей, которые, взаимодействуя друг с другом, выполняют одну и ту же функцию в определенный момент существования клетки. Эти модули придают клетке эволюционный потенциал, поскольку эволюционные изменения могут происходить внутри отдельного модуля, не затрагивая другие, и таким образом, не внося слишком сильных изменений в фенотип клетки, который в случае сильных искажений мог бы быть отвергнут естественным отбором. С другой стороны, модули - гибкие динамичные образования, так что компоненты одного модуля могут участвовать в функционировании других [16]. Модулярность функциональной организации клетки и ее генома сейчас рассматривается как один из наиболее фундаментальных принципов, определяющих функционирование живых систем и их эволюцию.
Эти замечательные выводы стали возможными только благодаря анализу последовательности полных геномов, то есть всей ДНК клетки. Однако есть и еще несколько чрезвычайно важных выводов, которые также следуют из полногеном-ного анализа и показывают его недостаточность.
Функции почти половины генов, которые идентифицируются в геноме, неизвестны. Даже у такого хорошо изученного организма, как Е. соli [17], функции более 40% генов представляют собой загадку. У упоминавшейся выше микоплазмы, используя базы данных, удалось приписать функции примерно 40% предсказанных белков и найти некоторое сходство еще для 44%. Остальные 16% не обнаруживают сходства с известными генами и могут отвечать за специфические микобактериальные функции. Многие из них способны кодировать продукты, которые имеют функции, уже известные в других организмах, однако структурное сходство, лежащее в основе функциональной общности, не может быть обнаружено, ибо по тем или иным причинам соответствующие гены очень быстро меняли структуру в процессе эволюции. Но возможно, что они кодируют продукты, обусловливающие уникальность данного организма. Вот как формулирует эту проблему известный специалист в области эволюции Р. Дулитл: "...если это продукты, которые до сих пор никогда не встречались биохимикам, то это означает, что половина клеточной биологии и биохимии остается вообще неизвестной, несмотря на столетие исследований" [13].
Проблема осложняется неопределенностью понятия функции. Я это обсуждал ранее в своих обзорах. Действительно, продукты, имеющие одинаковые биохимические функции in vitro (фосфатазы или киназы, например), могут выполнять совершенно разные функции в клетке в процессе ее жизнедеятельности. Эти различия определяются эволюционной историей организмов, которая, в свою очередь, определялась отбором фено-типических или, если быть ближе к геномам, функциональных свойств, необходимых для существования организма в среде его обитания. Без представления об эволюционной истории организма нельзя до конца понять его функциональные особенности. "Nothing in biology makes sense except in the light of evolution" *, - писал великий эволюционист Т. Добжанский [18]. В свою очередь, эволюционная история не может быть понята без интенсивного сравнительного анализа полных геномов.
* "В биологии ничего нельзя понять иначе, чем через призму эволюции".Число генов не коррелирует со сложностью организмов. В рассчитанном суммарном размере генома человека - 3.2 млрд. пар оснований - более половины ДНК занимают разные виды повторяющихся последовательностей, а в оставшейся половине 1.1% генома составляют экзоны, 24% - интроны, 75% - межгенная ДНК.Сравнение с некоторыми другими секвениро-ванными геномами (см. табл. 1) показывает, что размеры геномов растут с ростом сложности организмов. Это выглядит совершенно логично, хотя мы помним, что имеет место "С-парадокс", который говорит нам, что наблюдаемый 40000-кратный разброс размера геномов эукариотов ("С-значение") не связан со сложностью организма [19]. Затруднение представляет собой число генов: для генома человека оно составляет по оценкам [6, 7] 26000-31000 генов, кодирующих белки. Обнаружено также немногим более 740 генов, кодирующих РНК, и не кодирующих белки. Число кодирующих генов в последовательности генома человека лишь в два раза больше, чем у червя С. elegans (19000) и примерно равно числу кодирующих генов в геноме растения Arabidopsis taliana (26000) [10] и рыбы фугу [9]. Более того, геном такого сложного существа, как плодовой мушки D. melanogaster, содержит в себе даже меньше генов (около 13000), чем геном довольно примитивного червя (19000). Если оцененное число генов человека более или менее правильно (а споры по этому вопросу пока еще не затихли), то после "С-парадокса", мы столкнемся с новым парадоксом - независимостью сложности организма от числа генов. Некоторые авторы называют его "N-парадокс" [20].
Здесь нужно сказать, что сложность организма не так просто определить [21, 22]. Определение на уровне здравого смысла дал, к примеру, Д. Балтимор в своих рассуждениях по поводу появления черновой последовательности человеческого генома:
"Понимание того, что дает нам сложность нашего генома, - огромный набор особенностей поведения, способность заниматься сознательной деятельностью, замечательная физическая координация (как и у других позвоночных), точно согласованные изменения в реакциях на колебания окружающей среды, способность к обучению, память..." [21].Однако хотелось бы иметь хотя бы полуколичественное определение сложности, которое бы облегчило корреляцию сложности и числа генов. Для этой цели я предлагаю некоторые весьма приблизительные оценки сложности организмов, основанные на числе составляющих организм клеток и на числе нейронов, формирующих нейронную сеть:
Нетрудно увидеть огромное различие в сложности у С. elegans и Н. sapiens. Каким образом скромное различие в числе генов дает разрыв в сложности организмов? Я не имею возможности анализировать все источники непропорциональности сложности числу генов. Отмечу только, что наиболее вероятным представляются несколько факторов.
• Сильное увеличение функциональной нагрузки на один ген в процессе эволюции; в результате один ген человека выполняет существенно больше функций, чем один ген червяка.Мы не знаем, как гены и их ансамбли формируют фенотип. Наше знание о функциях генов сегодня обычно останавливается на информации типа "ген Х кодирует (или вовлечен в кодирование) признак Y". В таблице 2 приведено несколько примеров, как выглядит наше сегодняшнее знание о взаимосвязях генов и фенотипов. Я использую гены, расположенные на мужской половой хромосоме Y [28]. Половые вопросы очень волнуют людей, и исследованию связанных с полом генов, естественно, уделяется экстраординарное внимание. Например, гены SRY, RPS4Y и ZFY вовлечены в возникновение бесплодия у мужчин. И что мы знаем об их функциях? Один из них - фактор транскрипции, два другие - белок малой рибосомной субъединицы и Zn-фингерный фактор транскрипции, соответственно. Это совершенно недостаточное знание, чтобы понять, как фенотип (бесплодие) возникает вследствие мутаций в этих генах. Отсутствие информации о том, что происходит в интервале между генами и фенотипом, касается всех генов и всех признаков. Хуже всего то, что неясно, как его заполнять. Нужна новая научная революция, подобная той, которую совершила структура ДНК в генетике.• Резкое возрастание комбинаторных сочетаний продуктов, вовлеченных в выполнение одной функции, поэтому одна функция выполняется множеством генов, каждый из которых выполняет также и другие функции. Возникают сложные сети генных взаимодействий; в результате почти все многообразие признаков представляют собой сложные признаки, чрезвычайно трудно поддающиеся традиционному генетическому анализу, основывающемуся на идеологии менделевского анализа [24].
• Возрастание комбинаторных сочетаний сопровождается усложнением системы регуляции экспрессии генов, которая позволяет одному и тому же гену экспрессироваться в разные времена развития организма и в разных дифференцированных клетках.
• Множество генов не кодируют никаких белков и выполняют свои функции в виде РНК [25, 26]. В настоящее время даже грубая оценка числа таких генов невозможна. Только что появившийся анализ суммарного содержания РНК мыши [27] показывает, что РНК, некодирующих белки, может быть значительно больше, чем предполагалось ранее, поэтому, возможно, сложность вполне коррелирует с числом генов, просто мы пока не знаем этого числа.
Анализ множества полных геномов показывает нам, что в XXI столетии основной задачей всех наук о жизни будет расшифровка способов, которыми гены и их ансамбли формируют фенотип.
ЧТО ЕСТЬ ЖИЗНЬ? КАК ОРГАНИЗОВАНЫ И ЖИВУТ АТОМЫ ЖИЗНИ - КЛЕТКИ?
Суть проблем, о которых я говорил в предыдущих разделах, в очень концентрированной форме сформулировала группа исследователей во главе с К. Вентером, которые в 2001 г. опубликовали свой вариант последовательности генома человека:
"Мало кто не согласится, что мозг Эйнштейна более сложен, чем мозг дрозофилы. Однако понять причины этой сложности на основании просто сравнений, говорящих, что набор белков в мозге человека больше, чем у дрозофилы... вряд ли возможно. Скоро мы окажемся в положении, когда придется уходить от простого перечисления индивидуальных компонентов системы и от упрощенческих описаний типа «это связывается с тем, которое затем прикрепляется к тому, и все это движется туда...»Мы вынуждены будем прийти к изучению возмущений сетей (networks), нелинейным ответам и к пороговым принципам...
Простое исследование числа нейронов, типов клеток или генов само по себе не объясняет различия в сложности, которые мы наблюдаем. Скорее, это взаимодействия внутри и между этими системами приводят к таким громадным вариациям. Последовательность (генома) дает каркас, от которого зависит вся генетика, биохимия, физиология и, в конечном счете, фенотип. Она дает только первый уровень понимания генома.Все, что здесь сказано, отражает в полной мере ту неудовлетворенность, которую вызывает наше знание о механизмах жизнедеятельности. Вопрос заключается в том, как двигаться дальше, чтобы все-таки понять феномен жизни.Есть две ошибки, которые надо избегать: детерминизм, то есть идея, что все свойства индивидуума определяются геномом, и редукционизм -точка зрения, согласно которой мы, зная полную последовательность генома, в обозримое время придем к пониманию функций генов и взаимодействий и затем к полному описанию причин вариабельности людей.
Реальный вызов биологии человека, идущий далее простого выяснения, как гены дирижируют конструкцией и поддержанием нашего тела, ждет нас впереди. Мы должны понять, как наше сознание пришло к такой высокой организации, чтобы начать исследовать наше существование" [7].
Мне представляется, что сегодня главных результатов можно ждать на пути исследования организации простейших живых систем - отдельных клеток. В каком-то смысле клетка - атом жизни и, несомненно, необходимо понять строение и способы функционирования этих атомов. Биология XXI в. вышла на рубеж физики начала XX в., когда началась расшифровка структуры атомов и появились первые представления об их строении.
Существует три главных направления развития исследований, ориентированных на расшифровку функциональных свойств живых систем на атомарном уровне. Первое - интенсификация классических методов анализа функций и перенос этих методов на полногеномный уровень. Классическим примером подходов такого рода является использование микрочипов в анализе содержания РНК в клетке или множественный анализ взаимодействий белков. Массированные тотальные анализы, несомненно, позволят детализировать наши знания о функциональных взаимосвязях. Появятся компьютерные базы данных, представляющие собой громадные каталоги взаимодействий внутри клеток. В базе данных будут сведения о сетях внутриклеточных взаимодействий, их изменениях в процессах развития и клеточной дифференцировки, а также при различных патологиях. Этот подход интенсивно развивается, и значимость его трудно переоценить.
Другое направление, уже получившее первичный импульс, заслуживает несколько более пристального внимания. Речь идет о создании компьютерных моделей живых клеток, которые интегрировали бы все имеющиеся знания и продемонстрировали бы, как все элементы клетки работают в координации друг с другом. В процессе создания такой модели удалось бы также выявить реальные провалы в наших знаниях о структурах и их функциях в клетке, сфокусировать усилия на заполнении этих провалов. До настоящего времени были попытки моделирования отдельных клеточных структур, появление полногеномной информации создает предпосылки для моделирования целых клеток. Такие модели должны обладать предсказательной силой, демонстрируя весь комплекс реакций клетки на изменения окружающей или внутренней среды. Первый шаг в этом направлении сделан: организован международный консорциум, задача которого - создание полной компьютерной модели Е. соli [29]. Это логическое продолжение полно-геномных стратегий исследования живых систем.
Наконец, третье направление - это экспериментальное исследование, ориентированное на получение минимальной клетки. Такой подход, в частности, намерена осуществить знаменитая фирма TIGR, которая уже прославилась установлением структуры множества геномов. Ее проект состоит из двух частей. Во-первых, взять минимальную по числу генов бактерию и путем мутаций систематически уничтожать ген за геном, чтобы посмотреть на тот минимум, который окажется достаточным, чтобы обеспечивать ее жизнедеятельность. Роль микробного минималиста будет играть Mycoplasma genitalium, содержащая 517 генов. По данным на 2000 г., такой систематический подход показал, что только 265-350 генов из 480 генов бактерии, кодирующих белок, существенны дАя жизни клетки в лабораторных условиях. Исследование продолжается, и есть уверенность в том, что скоро будет установлено, сколько и каких генов необходимо для убогого, со всех сторон зависимого от опеки исследователей, но все же существования бактерии. Это откроет перспективу для изучения систем взаимодействий между модулями клетки, которые существенны для жизнеспособности, и заложит основу для понимания путей, ведущих от генотипа к формированию живого организма. Во-вторых, исследователи TIGR думают о создании полностью искуст-венной клетки, беря за основу минимальный набор компонентов, выведенный описанным выше способом. Этот абсолютно дерзкий план, может быть, еще нереален, но само его появление показывает, как далеко наука продвинулась на пути к ответу на вопрос, что такое жизнь, по крайней мере на простейшем уровне. Все это должно, конечно, сочетаться с систематическим анализом генетических изменений между видами в сопоставлении с изменениями функций.
Все эти подходы в конечном счете должны дать гармонизированную и полную картину функционирования живых систем на клеточном уровне. Эта картина может составить главный результат биологических исследований в XXI в. Биология, которая будет занята этими исследованиями, станет наукой, интегрирующей громадный конгломерат знаний и методов: математики, информатики, молекулярной биологии, генетики, клеточной биологии, физиологии, эволюционной биологии, физики, нанотехнологий и множества других.
Можно ли представить себе, что мы пришли бы к такому уровню знаний и возможностей анализа, если бы структура ДНК не была расшифрована? Это открытие инициировало гигантский каскад исследований, которые дали такой объем информации, что мы вправе надеяться получить, наконец, ответ на извечный вопрос: "Что такое жизнь?".
ЛИТЕРАТУРА
1. Watson J.D., Crick F.H.C. A structure for Deoxyribose Nucleic Acid // Nature 1953. V. 171. P. 737-738.
2. Кетр М. The Mona Lisa of modem science // Nature. 2003. V. 421. P. 41^420.
3. Chargaff E. Heraclitean Fire: Sketches from a Life before Nature. N.Y.: The Rockefeller University Press, 1978.
4. Ball P. Portrait of a molecule // Nature. 2003. V. 421. P. 421-422.
5. Свердлов Е.Д. Микрокосм генома // Мол. биол. 1999. Т. 33. С. 917-939.
6. Lander E.S., Linton L.M., Birren B. et al. Initial sequencing and analysis of the human genome // Nature 2001. V. 409. P. 860-921.
7. Venter J.C., Adams M.D., Myers E.W. et al. The sequence of the human genome // Science. 2001. V. 291. P. 1304-1351.
8. Mouse genome sequencing consortium. Initial sequencing and comparative analysis of the mouse genome // Nature. 2002. V. 420. P. 520-562.
9. Aparicio S., Chapman J., Stupka Е. et al. Whole-Genome Shotgun Assembly and Analysis of the Genome of Fugu rubripes // Science, 2002. V. 23. P. 1301-1310.
10. The Arabidopsis Genome Initiative.Analysis of the genome sequence of the flowering plant Arabidopsis thaliana // Nature. 2000. V. 408. P. 796-815.
11. Adams M.D., Celniker S.E., Holt R.A. et al. The Genome Sequence of Drosophila melanogaster // Science. 2000. V. 287. P. 2185-2195.
12. Mushegian A.R., Koonin E.V. A minimal gene set for cellular life derived by comparison of complete bacterial genomes // PNAS. 1996. V. 93. P. 10268-10273.
13. Doolittle R.F. Microbial genomes opened up // Nature. 1998. V. 392. P. 339-342.
14. Snel В., Bork P., Huynen М. Genome evolution:gene fusion versus gene fission // Trends in Genetics. 2000. V. 16. P. 9-11.
15. Andersson J.O., Doolittle W.F., Nesb C.L. Are There Bugs in Our Genome? // Science. 2001. V. 292. P. 1848-1850.
16. Thieffry D., Huerta AM., Perez-Rueda Е., Collado-Vides J. From specific gene regulation to genomic networks: a global analysis of transcriptional regulation in Escherichia coli // BioEssays. 1998. V. 20. P. 433-440.
17. Blattner FR., Plunkett G., CraidA. et al. The complete genome sequence of Echerichia coli K-12 // Science. 1997. V. 227. P. 1453-1461.
18. Dobzhansky Т. Genetics and the Origin of Species. N.Y.: Columbia University Press, 1951.
19. Cavalier-Smith Т. Nuclear volume control by nucleosk-eletal DNA, selection for cell volume and cell growth rate, and the solution of the DNA C-value paradox // J. Cell Sci. 1978. V. 34. P. 247-278.
20. Claverie J-M. What if there are only 30 000 human genes // Science. 2001. V. 291. P. 1255-1256.
21. Baltimore D. Our genome unveiled // Nature. 2001. V. 409. P. 814-816.
22. Koch С., Laurent G. Complexity and the Nervous System // Science. 1999. V. 284. P. 96-98.
23. Албертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки. М.: Мир, 1986.
24. Scriver C.R., Waters PJ. Monogenic traits are not so simple. Lesson from phenyiketonuria // Trends in Genet. 1999. V. 15. P. 267-272.
25. Eddy S.R. Non-coding RNA genes and the modem RNA world // Nature Reviews Genet. 2001. V. 2. P. 919-929.
26. Storz G. An expanding universe of noncoding RNAs // Science. 2002. V. 296. P. 1260-1263.
27. The FANTOM CONSORTIUM an the RIKEN Genome Exploration Research group Phase I&II Team // Nature. 2002. V. 420. P. 563-573.
28. Jobling M.A., Tyler-Smith С. New uses for new haplotypes: the human Y chromosome, disease and selection // Trends in Genetics, 2000. V. 16. P. 356-362.
29. Holden С. Alliance Launched to Model Е. coli // Science. 2002. V. 297. P. 1459-1460.
В. Л. Карпов
Карпов Вадим Львович - доктор биологических наук,
заведующий лабораторией Института молекулярной биологии им. В.А. Энгельгардта РАН.Геном каждой клетки человека составляют около 40 тыс. генов, но все они одновременно никогда не используются. Считается, что в каждом клеточном типе работает около 20 тыс. генов, хотя точное их число неизвестно. Как минимум половина всех работающих генов необходима для поддержания жизнедеятельности любой клетки, другая половина генов определяет, будет ли клетка принадлежать печени, почкам, селезенке, другому органу или ткани. В клетках печени активируются только те гены и синтезируются только те белки, которые необходимы для функционирования печени, в клетках почек активируются гены, необходимые для выполнения функций почек, и т.д. Итак, все клетки содержат одинаковую генетическую информацию, записанную в молекулах ДНК, но при развитии организма эта информация в тканях или органах считывается избирательно, что и приводит к огромному разнообразию клеток в организме.
Каков же механизм процесса, позволяющего клетке стабильно включать и выключать определенные гены, не теряя при этом в ДНК информацию обо всех генах?
Контроль избирательного включения-выключения генов осуществляют особые эпигенетические механизмы, а процесс передачи этого контроля от клетки к клетке называют эпигенетическим наследованием. "Эпи" в слове "эпигенетика" происходит от латинского "над", "сверх", и это означает, что записанная в ДНК информация не затрагивается, тут действуют другие, "надгенетические" механизмы. Именно они определяют будущее клетки: какой ей быть, какие гены включать для производства определенных белков, а какие - выключать.
Существует несколько уровней контроля активации генов. Один из них - модификация ДНК, соответствующая тем генам, которые необходимо выключить. Другими словами, на ДНК пишется некое послание о том, что этот ген должен молчать в данном типе клеток. Послание должно копироваться при удвоении ДНК, тогда и дочерняя клетка может узнать, что конкретный ген не должен работать. Однако ДНК сама по себе несет важнейшую функцию кодирования аминокислотной последовательности белков, и мы не можем произвольно ее модифицировать, не затронув этой информации и не изменив способности ДНК к удвоению.
Единственной изученной модификацией ДНК, которая не нарушает кодирование и копирование, является метилирование цитозина - одного из кирпичиков ДНК. Именно с помощью цитозина записывается информация на ДНК. Присоединение к нему метильной группы - трех атомов водорода и одного атома углерода - с функциональной точки зрения целое событие, приводящее к тому, что ген перестает работать. Речь, конечно, идет о метилировании участка ДНК, а не одного остатка цитозина. Важно, что эта модификация копируется при удвоении ДНК, которое происходит перед тем, как клетка начнет делиться. Особый фермент проверяет, есть ли на старой цепи метильная группа. Если есть, то фермент присоединяет метильную группу к вновь синтезируемой цепи, то есть модификация передается по наследству. Таким образом, в дочерней клетке сохраняется информация о том, что данный ген должен молчать.
Как же эта модификация влияет на активацию гена - на получение РНК-копии данного гена, служащей в дальнейшем матрицей для синтеза белка?
Возможны два механизма активации генов. Первый - отталкивание белков, активирующих ген, второй - привлечение к метилированной ДНК белков, которые избирательно узнают только метилированную ДНК и участвуют в очень плотной ее упаковке за счет изменения структуры хроматина - формы существования генома высших организмов. На уровне хроматина происходит основной контроль активации генов.
РОЛЬ ХРОМАТИНА В ЖИЗНИ КЛЕТКИ
В ряду организмов от прокариот до высших эукариот возрастающий объем генетической информации, кодированной в ДНК, требует упаковки ДНК в маленьком объеме. Линейный размер молекулы ДНК, например, человека достигает почти 2 м, тогда как диаметр ядра клетки не превышает 0.01 мм. Поэтому перед биологической эволюцией стояли, как минимум, две чрезвычайно сложные и в определенном смысле взаимно исключающие задачи. Во-первых, упаковать ДНК в микроскопическом объеме ядра, и во-вторых, сохранить при этом способность в нужный момент и в нужной комбинации извлекать из ДНК необходимую информацию. Решить эти внешне противоположные задачи помогает хроматин.
Представление о хроматине как окрашенном содержимом ядра клетки введено в науку еще в 1880 г., а сам термин "хроматин" предложен в 1888 г. Хроматин - чрезвычайно сложный и динамичный комплекс, в состав которого входят ДНК и белки. В живых клетках высших организмов именно хроматин служит носителем генетической информации. Избирательное и комбинаторное извлечение информации из ДНК, происходящее на уровне хроматина, а не только сама эта информация, приводят к огромному разнообразию фенотипического проявления наследственного материала. Неудивительно поэтому, что при почти 80%-ной схожести геномов человека и мыши, недавно почти полностью расшифрованных, эти два организма сильно отличаются друг от друга. На уровне хроматина, а не ДНК, наиболее эффективно работают многие ферменты, участвующие в избирательном считывании генетической информации, ее удвоении при делении клетки, исправлении возникающих при этом ошибок и т.д. Чтобы понять природу эпигенетических механизмов контроля активности генов, необходимо подробно остановиться на структуре самого хроматина.
Универсальные компоненты хроматина - белки гистоны, открытые в 1884 г. А. Косселем. По суммарной массе они сравнимы с ДНК, и их некоторое время считали носителями генетической информации. Потом им отводили роль регуляторов генной активности. Однако оказалось, что огромное разнообразие видов гистонов, на которое опиралась данная гипотеза, было связано с методом их выделения, приводящем к интенсивной деградации этих распространенных белков. После введения метода кислотной экстракции гистонов все их разнообразие свелось к пяти основным типам: H1, Н2А, Н2В, НЗ и Н4 (Н - от английского "Histone", цифры и буквы обозначают номера фракций при хроматографической очистке гистонов). Гистоны принадлежат к наиболее консервативным по первичной структуре белкам в ряду от простейших эукариот до высших. Например, аминокислотные последовательности гистона Н4 из вилочковой железы теленка и проростков гороха различаются только по двум положениям из ста двух.
Гистоны - это небольшие по молекулярной массе белки с высоким содержанием положительно заряженных аминокислотных остатков - лизинов и аргининов, локализованных преимущественно в N- и С-концевых неструктурированных областях белка, так называемых "хвостах". Их функция долгое время оставалась непонятной, существовало даже мнение, что они не очень важны для нормального функционирования клетки. Однако, как выяснилось позже, именно гистоновые "хвосты" играют главную роль в эпигенетических механизмах. В центральных, наиболее консервативных, участках гистонов преобладают гидрофобные аминокислотные остатки, необходимые для белок-белкового узнавания. Именно на этих участках образуются специфические комплексы молекул гистонов - тетрамер (НЗ)2(Н4)2 и димер Н2А-Н2В. Способность гистонов образовывать комплексы определяет чрезвычайно важную их функцию в клеточном ядре: формирование нуклеосомного ядра, или кора (от английского "core", сердцевина, ядро) - мультибелкового комплекса, вокруг которого навивается ДНК.
В основе формирования нуклеосомы, открытой в 1973-1974 гг., лежат несколько принципов, сформулированных А. Корнбергом [1]. Нуклеосома состоит из восьми молекул комплекса гистонов: по два гистона Н2А и Н2В с высоким содержанием лизина, по два богатых аргинином гистона НЗ и Н4. На этот гистоновый октамер (кор) навивается ДНК в виде левозакрученной суперспирали с шагом 28 А, содержащей 80 пар нуклеотидов на виток. Всего на кор в нуклеосоме навивается 1.75 витка, что составляет 146 пар нуклеотидов. Такую нуклеосому называют "минимальной", или "кор-нуклеосомой". Если в состав нуклеосомы входит гистон H1, который связывается с межнуклеосомной ДНК, или линкером (отсюда -"линкерный" гистон), то такую нуклеосому называют "полной". В этом случае на нуклеосому навивается 2-2.5 витка ДНК, что составляет 160-200 пар нуклеотидов. Образуя кор, гистоны взаимодействуют с ДНК в нуклеосоме строго определенным образом.
В конце 1970-х годов в Институте молекулярной биологии в лаборатории А.Д. Мирзабекова был разработан метод анализа ДНК-белковых взаимодействий, основанный на ДНК-белковых сшивках, с помощью которого была расшифрована последовательность расположения гистонов в нуклеосоме [2]. Она оказалась одинаковой в организмах, принадлежащих не только к разным видам и классам, но даже царствам живой природы: в грибах, растениях и животных порядок расположения гистонов в нуклеосоме неизменен. Это открытие объяснило высокую консервативность гистонов, необходимую для образования такого сложного комплекса, как нуклеосома.
Большой вклад в формирование идей о многоуровневой упаковке ДНК в составе хроматина внесли работы Г.П. Георгиева и Ю.С. Ченцова [3]. Последовательно расположенные нуклеосомы формируют 100 А фибриллу, представляющую собой первый уровень упаковки ДНК; коэффициент компактизации при этом равен 6-7. Далее с участием линкерного гистона HI формируется 30 нм фибрилла. В результате ДНК компактизируется еще в 20-50 раз. Предложено много версий для объяснения того, как это происходит, но до сих пор к единому мнению исследователи не пришли. Еще меньше известно о высоких уровнях упаковки ДНК в петли и домены. Однако ни у кого нет сомнений, что нуклеосома играет центральную роль в упаковке ДНК на всех уровнях. Именно межнуклеосомные взаимодействия определяют степень компактизации ДНК.
Уникальным экспериментальным методом, позволяющим получать данные о пространственном расположении атомов в кристалле, служит дифракция рентгеновских лучей, или рентгенострук-турный анализ. Пространственное расположение атомов в кристаллах сложных биополимеров также можно определить, измеряя углы и интенсивности отражения и рассеяния рентгеновских лучей электронами, окружающими каждый атом. Атомы, обладающие большой электронной плотностью (например, атомы тяжелых металлов), интенсивно рассеивают рентгеновские лучи; атомы с меньшей электронной плотностью (например, атомы водорода) рассеивают рентгеновские лучи менее интенсивно. Рентгеноструктурный анализ кристаллов простых солей - задача несложная, поскольку в них находится всего несколько атомов, правильно расположенных в пространстве. В случае биополимеров математический анализ получающихся дифракционных картин чрезвычайно сложен, так как большое количество атомов в биополимере дает тысячи и тысячи дифракционных рефлексов. Рентгеноструктурный анализ кристалла нуклеосомы особенно сложен в силу многокомпонентности этого комплекса. Тем не менее в Англии в лаборатории Т. Ричмонда [4] получены изображения нуклеосомы с высоким разрешением - до 2.8 А (рис. 1). Благодаря им мы стали лучше понимать, какие нуклеосомные механизмы участвуют в компактизации хроматина.

Рис. 1. Структура нуклеосомы с разрешением 2.8 А. Вид вдоль оси суперспирали ДНК
На рисунке изображены: половина нуклеосомы, ее центр (положение оси) отмечен цифрой 0; виток суперспирали ДНК (73 пары нуклеотидов), цифрами обозначены витки двойной спирали; гистоны в виде цилиндров, их С- и N-"хвосты", места ДНК-гистоновых контактов показаны белыми крюкамиВ основе организации нуклеосомы лежит принцип многоуровневого узнавания. На первом уровне гистоны попарно узнают друг друга. Здесь существенное значение имеют центральные структурированные области гистонов. Молекула каждого гистона состоит из центрального структурированного трехспирального домена (одного длинного и двух коротких альфа-спиральных участков, соединенных петельным сегментом, так называемая гистоновая укладка) и двух неструктурированных N- и С-"хвостов" (рис. 2). Спиральные домены гистонов взаимодействуют друг с другом, формируя структуры, названные "рукопожатием", в результате чего образуются гетеродимеры НЗ-Н4 и Н2А-Н2В. Эти димеры в свою очередь образуют тетрамер НЗ-Н4 и два димера Н2А-Н2В, формирующие гистоновый октамер.
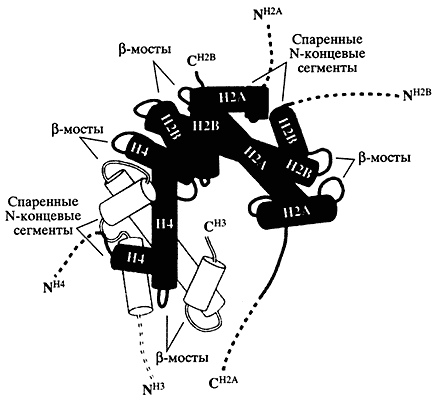
Рис. 2. Схема "гистоновой укладки" и ДНК-связывающего мотива (фрагмент).
Вид сверху вдоль оси суперспирали ДНКСпиральные домены гистона НЗ изображены в виде белых цилиндров, остальные гистоны - в виде черных; пунктирные линии соответствуют приблизительному положению гибких гистоновых "хвостов"; двойными стрелками (>) отмечены шесть регулярно расположенных доменов, участвующих в связывании ДНКГистоновый октамер имеет клинообразную форму, обеспечивающую левое закручивание спирали ДНК вокруг себя. На его поверхности, обращенной к ДНК, формируются белковые структуры, или мотивы, которые можно разделить на три основных типа (см. рис. 2). Мотивы первого типа образованы спаренными петельными сегментами гистоновых димеров (так называемые бета-мосты). Мотивы второго типа представляют собой спаренные N-концевые сегменты первых спиральных доменов каждого гистона в гетеродимерах. Наконец, к третьему типу относят два мотива, которые формируются двумя дополнительными альфа-спиральными участками гистона НЗ, расположенными по концам суперспирали ДНК, где ДНК входит и покидает нуклеосому. Суммарное число всех мотивов равно 14, что соответствует числу витков двойной спирали ДНК, накрученной вокруг октамера.Все эти мотивы содержат положительно заряженные аминокислоты (в основном аргинины), что обеспечивает электростатический контакт октамера с отрицательно заряженными фосфатами сахарофосфатного остова ДНК. Таким образом, 14 малых бороздок ДНК втягивают в себя 14 аргинин-содержащих мотивов гистонового октамера, расположенных на поверхности гистонового кора и обращенных к ДНК. Это приводит к жесткому фиксированию ДНК, которое в малой степени зависит от ее нуклеотидной последовательности, что и обеспечивает универсальность компактизации ДНК на нуклеосомах. Консервативная глобулярная часть гистонов участвует в формировании гистонового октамера и фиксировании на нем молекулы ДНК. Так обеспечивается первый уровень компактизации. При этом ДНК оказывается на поверхности кора и остается доступной для взаимодействия с другими белками.
Интересно, что мотив "гистоновой укладки" обнаружен во многих белках, выполняющих функцию активаторов и репрессоров считывания ДНК, что указывает на эволюционную связь между структурой хроматина и механизмом транскрипции (переписывание генетической информации в копии РНК).
В чем заключается роль гистоновых "хвостов"? Рентгеноструктурный анализ нуклеосом дает ответ и на этот вопрос. Оказалось, что суперспираль ДНК в нуклеосоме закручена так, что обеспечивается выход "хвостов" гистонов на поверхность нуклеосомы. "Хвост" гистона НЗ простирается далеко от места выхода на поверхность нуклеосомы и фиксируется межнуклеосомными контактами. "Хвост" гистона Н4 имеет много контактов с поверхностью димера Н2А-Н2В соседней нуклеосомы. "Хвосты" гистонов выходят на поверхность хроматиновой фибриллы (рис. За), участвуют в межнуклеосомном взаимодействии, очень подвижны и подвергаются многочисленным модификациям. Среди последних - ацетилирование, фосфорилирование, метилирование, убиквитинилирование и АДФ-рибозилирование [5]. Эти модификации приводят к изменению заряда, гидрофобности и других свойств поверхности белковых глобул.
Гистоновые "хвосты" располагаются над поверхностью хроматиновой фибриллы и составляют до 25-30% массы индивидуальных гистонов, обеспечивая с помощью различных заряженных групп мозаичное "раскрашивание" поверхности монотонного хроматина. Кроме того, специализированные для гистоновых "хвостов" модифицирующие ферменты могут вызвать комбинаторное изменение этой мозаики. Таким образом, формируется сложная матрица для узнавания ее другими регуляторными белками, внешними сигналами. Более того, поскольку концевые домены гистонов участвуют и в межнуклеосомном взаимодействии, модификации влияют и на характер упаковки хроматиновой фибриллы, разрыхляя или, наоборот, уплотняя ее, что, в свою очередь, облегчает или затрудняет доступ к ДНК многочисленным регуляторным факторам.На поверхности нуклеосомы N-конец гистона НЗ, как и концы других гистонов, представлены в виде консервативного домена; на схеме гистона НЗ отмечены места наиболее распространенных посттрансляционных модификаций: ацети-лирование (флажок), фосфорилирование (кружок) и метилирование (шестиугольник), вполне возможны и некоторые модификации в глобулярном домене; обращает на себя внимание пространственная регулярность мест модификаций, звездочка указывает на то, что Lys-9 может быть как ацетилирован, так и метилирован
В последние годы стало ясно, что все эти свойства "хвостов" гистонов в структуре нуклеосомы имеют чрезвычайно важное значение для расшифровки и понимания механизмов функционирования хроматина, его поведения при активации генов, их репрессии и многих других процессов, связанных с доступом к ДНК. Наиболее разработанной в настоящее время моделью функционирования хроматина считается "гистоновый код". Это - разнообразный набор модификаций гистоновых "хвостов" на поверхности нуклеосом, который можно целенаправленно менять и передавать по наследству. Он и определяет функциональное состояние гена. "Гистоновый код", по-видимому, является основным эпигенетическим механизмом, контролирующим включение или выключение генов и передачу программы этого контроля по наследству от клетки к клетке.
ЯЗЫК, НА КОТОРОМ ДНК РАЗГОВАРИВАЕТ С КЛЕТКОЙ
Достаточно долго полагали, что структура хроматина статична и гистоны выполняют лишь пассивную роль в сворачиваний чрезмерно длинной для ядра клетки молекулы ДНК, а сам хроматин - отнюдь не ключевой игрок на поле генной регуляции. Считали (так было проще думать), что механизмы контроля транскрипции в эукариотах независимы от хроматина. Существование нуклеосомы у эукариот мешало созданию многочисленных моделей, основанных на схеме Жакоба и Моно, предложенной для описания регуляции активности прокариотических генов. Согласно этой модели, факторы транскрипции узнают без посредников регуляторные участки ДНК, связываются с ними и запускают машину транскрипции генов. Однако накапливающиеся экспериментальные данные и расшифровка структуры нуклеосомы в корне изменили наши представления о роли гистонов в механизмах, ответственных за процессы, которые происходят на ДНК-матрице, такие как транскрипция (получение РНК-копии гена), репликация (удвоение ДНК), репарация (исправление повреждений ДНК) и деление хромосом [6]. Хроматин сейчас уже не выглядит как скучный инертный материал, выполняющий роль упаковки. Становится ясно, что транскрипция в значительной степени контролируется вариациями структуры хроматина, при этом существует тщательная инструкция для факторов транскрипции, использующих различные ферменты, которые напрямую или опосредованно способствуют перестройке хроматина.
Ключевым событием, изменившим наши представления о роли хроматина в активации генов, стало открытие в активаторных и репрессор-ных белковых комплексах, связывающихся с регуляторным участком генов (промотором) и управляющих работой гена, ферментов, вносящих или удаляющих определенные модификации с гистоновых "хвостов". Более того, число модификаций, их качественный состав и специфический набор определяют судьбу гена: быть ему активным или неактивным. Выяснилось, что эти модификации сохраняются при клеточном делении и передаются по наследству, а мутации белков, ответственных за передачу, приводят к полной потере клеткой способности к развитию и в конечном счете к гибели. "Гистоновый код" оказался идеальным эпигенетическим механизмом, с помощью которого можно писать программу каскадного включения-выключения генов при развитии, не затрагивая информацию о белках, записанную на самой ДНК.
Места модификации гистонов весьма консервативны, специфичны и специализированы для определенных функций. Например, в хвостовых доменах гистонов НЗ и H4 (см. рис. 3) модификациям подвергаются в основном аминокислоты, несущие реакционноспособные химические группы, как правило, заряженные. Важность модификаций концевых доменов гистонов уже давно показана в опытах по замене в "хвосте" гистона H4 всех лизинов на другие аминокислоты (при этом теряется возможность модификации). Это вызывало гибель клетки. Замена всех лизинов на глютамины (аминокислоты с другим суммарным зарядом) нарушает определенное распределение зарядов на поверхности нуклеосомы, после чего останавливается деление клетки. Однако, если с помощью генно-инженерных методов добавить всего один остаток лизина на N-конец гистона, клетка вновь переходит к делению.
Комбинации различных модификаций гистоновых "хвостов" важны для поддержания активного или неактивного состояния генов (рис. 4). Известно, что "хвосты" гистонов НЗ и H4 подвергаются различным модификациям по определенным аминокислотам и в определенном положении. Эти модификации взаимно влияют друг на друга: каждая из них способствует или препятствует следующей модификации. Важны комбинации модификаций: их определенные сочетания сообщают гену, работать ему или нет (см. рис. 4, б) [5].
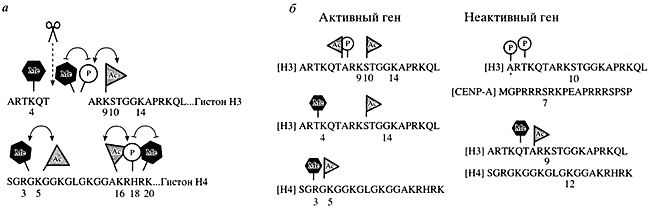
Рис. 4. Модели активации и репрессии генной активности на основе гипотезы "гистонового кода"
а - синергетическое, или взаимно усиливающее (связано стрелками), и антагонистическое, или взаимно ослабляющее (связано блокированной линией), действие модификаций N-концевых доменов гистонов НЗ и H4, пунктирная стрелка с ножницами указывает на возможное протеолитическое расщепление N-конца гистона НЗ;В клетке обнаружены ферменты, специально предназначенные для модификации гистоновых "хвостов". Среди них можно выделить гистоновую ацетилтрансферазу, ответственную за присоединение ацетильной группы к определенным лизинам, гистоновую метилтрансферазу, которая присоединяет метильную группу к лизиновым и/или аргининовым остаткам гистонового "хвоста", и гистоновые киназы, переносящие фосфатную группировку на серины и гистидины. Обнаружены также многочисленные ферменты, специализирующиеся на удалении этих групп с гистоновых "хвостов". Они часто встречаются в сложных белковых комплексах, участвующих в регуляции активности генов. Из этого следует, что существует определенный баланс между различными ферментами, которые считывают "гистоновый код" и переключают его, изменяя степень компактизации хроматина и, соответственно, активности гена.б - схема комбинаторной модификации N-концевых доменов гистонов, которые несут на себе "отпечатки" активного и неактивного хроматина
Гипотеза "гистонового кода" предполагает, что маркировки на модифицированных концевых доменах гистонов должны узнаваться регуляторными белками. Первым был обнаружен так называемый бромодомен, который специфически узнавал ацетилированные лизины на гистоновых "хвостах". Бромодомен присутствует во многих регуляторах транскрипции генов. Белок ТАFII250 (субъединица базального транскрипционного фактора TFIID) узнает, например, комбинацию нескольких ацетильных групп и имеет две последовательно расположенные копии бромодомена, каждая из которых узнает свою ацетильную группу. В этом тоже проявляется комбинаторный характер "гистонового кода". Бромодомен обнаружен более чем в 75 белках человека. Некоторые из них, например полибромодоменный белок 1, обладают шестью бромодоменами и узнают уникальную комбинацию ацетильных групп, сформированную модифицированными "хвостами" разных гистонов.
Другой белковый домен, узнающий метиль-ные маркировки на гистоновых "хвостах", называется хромодоменом. Из несущих хромодомен белков лучше всего изучен НР1 (от английского "heterochromatin protein"). Этот белок принимает участие в структурной организации гетерохроматина - области хроматина, находящейся в высоко-конденсированном состоянии, где все гены репрессированы. Таким образом, белок НР1 - это маркер неактивного состояния хроматина. Он имеет высокое сродство к метилированному 9-му лизину (Lys-9) гистона НЗ. Связываясь с метилированным "хвостом" гистона НЗ в одной нуклеосоме, белок НР1, в свою очередь, метилирует соседние нуклеосомы, что вызывает расползание области метилирования хроматина [6]. Таким образом достигается эффект высококонденсированного состояния на протяженных участках хроматина. Гены, попадающие в эту область, перестают работать, что часто называют "эффектом положения". Мало известно о белковых доменах, узнающих другие модификации "хвостов" гистонов, таких как фосфорилирование, убиквитини-лирование, АДФ-рибозидирование. Сейчас интенсивно ведется их поиск.
КАК РАБОТАЕТ "ГИСТОНОВЫЙ КОД"?
Многочисленные модификации гистоновых "хвостов", экспонированные на поверхности хро-матиновой фибриллы, и их комбинации, огромный набор специализированных ферментов, узнающих эти комбинации, позволяют записать очень сложную программу последовательности включения-выключения генов. В этом случае генетической информации, записанной на ДНК, оказывается недостаточно для получения полноценного организма. К информации должна прилагаться инструкция по ее использованию. Подтверждение тому - огромные сложности при получении клонов животных.
Если берется ДНК из клетки любого органа и переносится в яйцеклетку, где все подготовлено к тому, чтобы дать развитие новому организму, то выясняется, что эпигенетические механизмы развития в исходной клетке давно запущены, стереть эту информацию невозможно и многие гены уже никогда не смогут начать работать. Несмотря на то, что имеется полная генетическая копия, то есть геном представлен абсолютно такой же ДНК, как запустить программу развития, клетка не знает. Этой информацией обладают только ДНК половых клеток и так называемых эмбриональных стволовых клеток - первые деления оплодотворенной яйцеклетки. Только на этой стадии эпигенетические механизмы еще не включены, и клетка может стать и клеткой печени, и клеткой мозга, и клеткой кожи. Сначала казалось, что, расшифровав полную генетическую информацию геномной ДНК, мы сможем управлять процессами, происходящими в клетке. Однако выяснилось, что важна еще и эпигенетическая информация, язык которой гораздо сложнее и от полной расшифровки которой мы еще очень далеки.
Как может реализоваться "гистоновый код" в процессе включения-выключения генов, какова природа белков, узнающих модифицированные концевые домены гистонов, какую функцию они выполняют после узнавания хроматиновых маркировок?
Рассматривается несколько возможных вариантов. Согласно одному из них, модификации гистоновых "хвостов", участвующих в межнуклеосомных взаимодействиях, сами по себе могут изменять характер этого взаимодействия как со знаком минус, так и со знаком плюс. При изменении суммарного заряда гистоновых "хвостов", выступающих на поверхности нуклеосомы, может, например, уменьшиться степень компактизации хроматиновой фибриллы, и ДНК станет доступной для регуляторных белков. В этом случае роль ферментов, модифицирующих "хвосты" гистонов, заключается только в расширении зоны модификаций, усилении эффекта декомпактиза-ции (или компактизации, как это было отмечено для белка НР1). В пользу этого свидетельствуют данные о том, что многие белки, имеющие в своем составе бромо- или хромодомены, сами способны модифицировать гистоновые "хвосты" [6].
Другой механизм изменения статуса гена, маркированного определенными сигналами по "хвостам" гистонов, связан с факторами перестройки хроматина. В 1992 г. на дрожжах впервых было показано, что в присутствии АТФ (энергетических аккумуляторов клетки) определенные белковые комплексы обладали способностью изменять структуру хроматина, удаляя или сдвигая нуклео-сомы с регуляторных участков ДНК. При этом активировались молчащие гены [7]. Оказалось, что в состав такого комплекса входят белки, несущие бромодомены, хромодомены, избирательно узнающие модифицированные "хвосты" гистонов. Это позволяет целенаправленно доставлять комплекс к регуляторному участку гена, где и происходят структурные изменения в хроматине [8], облегчающие доступ к ДНК белкам, активирующим транскрипцию этого гена.
Структурные изменения в хроматине с помощью факторов перестройки затрагивают в основном небольшие регуляторные области генов. Основная же часть ДНК упаковывается при участии нуклеосом, и хотя активация генов вызывает достаточно сильную модификацию нуклеосом, они все еще остаются барьером для прохождения молекул РНК-полимеразы при транскрипции. Как же преодолевается этот барьер?
Разработан оригинальный метод картирования ДНК-белковых контактов вдоль ДНК на основе ковалентных сшивок - метод гибридизации с "белковыми тенями" [9]. С его помощью было показано, что проникающие в нуклеосому молекулы РНК-полимеразы провоцируют в ней временный структурный переход: без потери контакта гистонового тетрамера НЗ-Н4 с ДНК из нуклеосомы удаляется димер гистонов Н2А-Н2В, что облегчает продвижение полимеразы сквозь нуклеосому. После прохождения полимеразы структура нуклеосомы быстро восстанавливается. Эти данные соответствуют современным представлениям об организации нуклеосомы, согласно которым димер гистонов Н2А-Н2В в определенных условиях может удаляться [10].
Есть свидетельства, что белки, узнающие "гистоновый код", выполняют транспортную функцию: доставляют к необходимым генам комплекс регуляторных белков, порождающих целый каскад биохимических реакций в области хроматина, который соответствует регуляторному участку гена. В состав комплекса могут входить как модифицирующие белки, так и транскрипционные факторы, последние тоже могут подвергаться модификациям, необходимым для их активности.
Еще один механизм изменения степени компактизации хроматина и регуляции генной активности основан на структурных особенностях нуклеосомы - на замещении некоторых гистонов в ее составе на их гистоновые варианты. Так называют белок, структура которого в основном совпадает со структурой гистона, но свойства несколько измененены из-за того, что по некоторым функциональным доменам происходят аминокислотные замены. Как уже было сказано ранее, межнуклеосомные взаимодействия и распознавание хроматиновой фибриллы различными факторами определяются "хвостами" гистонов, экспонированными на поверхности фибриллы. Структуру хроматина можно нарушить, модифицировав "хвосты" этих гистонов, а можно заменить целиком весь гистон, отличающийся по N-концу (гистоновый вариант). В обоих случаях достигается равнозначный результат.
Уже давно из клеток различных организмов и различных тканей одного и того же организма выделяли такие гистоновые варианты. Например, у человека обнаруживается, как минимум, пять разных вариантов гистона Н2А [11]. Лучше всех изучен гистоновый вариант H2A.Z, обнаруженный у всех эукариот - от дрожжей до человека, при этом он чрезвычайно консервативен. От нормального гистона Н2А он отличается аминокислотной последовательностью, соответствующей домену, который ответственен за взаимодействие димера Н2А-Н2В с тетрамером НЗ-Н4, а также заменами в N-концевом "хвосте". Нуклеосомы, содержащие в своем составе данный вариант гистона Н2А, меняют свои поверхностные свойства. В результате меняется характер взаимодействия соответствующего гистонового "хвоста", отвечающего за межнуклеосомные взаимодействия, то есть создается определенный набор поверхностных зарядов [11]. Из-за этого нарушается степень конденсации хроматина. Таким образом, данный гистоновый вариант приводит к стабильному деконденсированному состоянию, необходимому для активации генов. Важность такого варианта для клетки подтверждается тем, что мутации по гену этого гистона летальны.
Другой хорошо изученный гистоновый вариант - Н2АХ. Отличительная его особенность в том, что один из аминокислотных остатков на С-конце гистона подвергается фосфорилированию в ответ на двуцепочечный разрыв ДНК, вызванный ионизирующим излучением или другими причинами. Фосфорилированный Н2АХ моментально притягивает к себе репарационный комплекс белков, главная функция которого состоит в исправлении повреждений ДНК. Этот механизм используется клеткой не только при случайных повреждениях ДНК, но и при программируемом разрыве. Такие разрывы происходят, например, при созревании половых клеток, когда идет обмен участками гомологичных хромосом; при развитии иммунной системы, когда для получения огромного разнообразия антител необходим разрыв и воссоединение определенных участков ДНК; наконец, при апоптозе (программируемой смерти клетки) на начальной стадии фрагментации высокомолекулярной ДНК [12].
В последние годы обнаруживаются все новые и новые способы изменения компактизации хроматина и соответствующего изменения активности гена, основанные на гипотезе "гистонового кода". Становится очевидным, что клетка не обладает единым механизмом узнавания, считывания и переключения "гистонового кода", а использует комбинацию разных механизмов. Поиски их весьма актуальны.
Изучение эпигенетических механизмов давно уже перестало быть только проблемой фундаментальной науки. Известно, например, что при онкологических заболеваниях и некоторых вирусных инфекциях нарушается контроль над сбалансированным в нормальной клетке процессом ацетилирования-деацетилирования гистонов. Так, аденовирусный онкобелок Е1А ингибирует активность гистоновой ацетилтрансферазы, а подавление роста клеток раковой опухоли определенным белком зависит от взаимодействия этого белка с гистоновой деацетилазой, удаляющей ацетильные группы с гистонового "хвоста". Хорошо изучена роль ретинобластомного белка (RB) в нарушении механизмов регулирования структурных переходов в хроматине. При многих раковых заболеваниях обнаружены мутации этого белка, которые препятствуют его связыванию с факторами транскрипции. Такой комплекс не связывается, в свою очередь, с гистоновой деацетилазой. В результате молчащие в нормальной клетке гены начинают работать, что и приводит к раковой патологии. Более того, некоторые вирусные он-кобелки обладают способностью целенаправленно блокировать взаимодействие ретинобластомного белка с гистоновой деацетилазой [6].
Еще одним доказательством связи процессов канцерогенеза и старения с посттрансляционными модификациями гистонов стало обнаружение взаимозависимости процессов метилирования Lys-9 гистона НЗ и метилирования ДНК [12]. Давно уже известно, что уровень и характер метилирования ДНК отклоняется от нормы при канцерогенезе и старении. Понимание того, что метилирование ДНК определяется эпигенетическим молчанием хроматина, проливает свет на механизмы этих процессов. Происходит одновременное выключение генов, продукты которых подавляют раковые опухоли, и активация генов, необходимых для роста раковой опухоли. Расшифровка специфического эпигенетического "ракового кода" и "кода старения" на уровне метилирования ДНК, определяемого метилированием гистоновых "хвостов", имеет огромное практическое значение и уже сейчас может использоваться для диагностики раковых заболеваний. Более того, подбор соответствующих препаратов в идеале может изменить "раковый код" и вернуть клетку к нормальному состоянию.
Прогресс в изучении механизмов реализации генетической информации позволяет по-новому взглянуть на природу многих изменений, происходящих в клетке при патологических процессах, вирусных и других инфекциях, раковых заболеваниях и старении. Расшифровка этих механизмов поможет нам контролировать генетический потенциал, а значит, и создавать полезные для человека породы домашних животных и сорта растений, находить эффективные средства борьбы с болезнями и, наконец, продлевать здоровую жизнь человека.
ЛИТЕРАТУРА
1. Kornberg R.D. Chromatin structure: a repeating unit of histones and DNA // Science. 1974. V. 184. P. 868-871.
2. Mirzabekov A.D., Shick V.V., Belyavsky A.V., Bavykin S.G. Primary organization of the nucleosome core particle of chromatin: Sequence ofhistone arrangement along DNA // Proc. Natl. Acad. Sci. USA. 1978. V. 75. P. 4184-4188.
3. Георгиев Г.П., Ченцов Ю.С. О структуре клеточного ядра (экспериментальное электронно-микроскопическое исследование изолированных ядер) // Докл. АН СССР. 1960. № 132.
4. Lager К., Mader A.W., Richmond R.K., Sargent D.F., Richmond T. Crystal structure of the nucleosome core particle at 2.8 A resolution // Nature. 1997. V. 389. P. 251-260.
5. Jenuwein Th., Allis C.D. Translating the histone code // Science. 2001. V. 293. P. 1074-1080.
6. Berger S.L., Felsenfeld G. Chromatin goes global // Molecular Cell. 2001. V. 8. P. 263-268.
7. Peterson C.L., Herskowitz I. Characterization of the yeast SWII, SW12, and SW13 genes? Which encode a global activator of transcription // Cell. 1992. V. 68. P. 573-583.
8. Hayes J.J. Changing chromatin from the inside // Nature Structural biology. 2002. V. 9. P. 161-163.
9. Karpov V.L., Preobrazhenskaya O.V., Mirzabekov A.D. Chromatin structure of hsp70 genes, activated by heat shock: selective removal of histones from the coding region and their absence from the 5' region // Cell. 1984. V. 36. P. 423^31.
10. Adelman К., Lis J.T. How does Pol II overcome the nucleosome barrier? // Molecular Cell. 2002. V. 9. P. 451-457.
11. Redon Ch., Pilch D., Rogakou E., Sedelnikova 0., Newrock K., Banner W. Histone Н2А variants Н2АХ and H2AZ // Current Opinion in Genetics and Development. 2002. V. 12. P. 162-169.
12. Jones P. DNA methylation and cancer // Oncogene. 2002. V. 21. P. 5358-5360.
Июнь 2003