| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
том 73, № 8, С. 712-721 (2003) |
| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
том 73, № 8, С. 712-721 (2003) |
© Ю.М. Евдокимов
ЖИДКОКРИСТАЛЛИЧЕСКИЕ ФОРМЫ
НУКЛЕИНОВЫХ КИСЛОТ
К 50-летию открытия структуры ДНКЮ. М. Евдокимов
Евдокимов Юрий Михайлович - д.х.н., зав. лаб. Института молекулярной биологии им. В.А. Энгельгардта РАН.Вопрос о состоянии ДНК в биологических объектах (вирусы, хромосомы простейших и т. д.) был поставлен сразу же после открытия структуры ДНК 50 лет назад. Согласно расчетам, объем, занимаемый молекулой ДНК в растворе, в несколько тысяч раз превышает объем головки простого бактериофага (вирус бактерии), в которой размещается эта ДНК. Следовательно, внутри бактериофага локальная концентрация ДНК может достигать сотен миллиграмм в одном миллилитре, то есть в тысячи раз отличается от концентрации, с которой обычно работают в лабораторных условиях. Аналогичные расчеты свидетельствуют о высокой плотности упаковки молекул ДНК и в хромосомах высших организмов, где молекулы ДНК связаны с различными белками. Характерно, что в биологических объектах молекулы ДНК не только сконцентрированы (конденсированы), но и высокоупорядочены, судя по рефлексам на рентгенограммах этих объектов. Таким образом, неотъемлемое свойство биологических объектов - плотная упаковка молекул ДНК, причем такая, которая легко и обратимо меняется в ходе биологических процессов.
Выяснение конкретного механизма (или механизмов) функционирования генома в клетке -трудная экспериментальная задача, для однозначного решения которой методы анализа еще не разработаны, поэтому большое значение приобрело моделирование процесса конденсации молекул ДНК в лабораторных условиях.
Рассмотрим некоторые результаты, полученные главным образом в Институте молекулярной биологии им. В.А. Энгельгардта РАН. Основной вывод из проведенных работ состоит в том, что при всех условиях, вызывающих фазовое исключение молекул двухцепочечных нуклеиновых кислот из водно-полимерных или водно-солевых растворов, эти молекулы находятся преимущественно в жидкокристаллическом состоянии. Интерес к жидким кристаллам нуклеиновых кислот обусловлен не только их большой биологической значимостью, но и обнаруженной сравнительно недавно возможностью их применения в практических целях, например, в качестве чувствительных элементов сенсорных устройств [1] или "носителей" генетического материала, а также в составе соединений, используемых в медицине либо биотехнологии.
Конденсированное состояние высокомолекулярных двухцепочечных ДНК. В исследованиях жидкокристаллического состояния молекул нуклеиновых кислот существуют два взаимодополняющих направления: внутримолекулярная конденсация единичных молекул высокой молекулярной массы [2] и межмолекулярная конденсация молекул низкой молекулярной массы [3]. Эксперименты однозначно доказали, что в результате внутримолекулярной конденсации, происходящей при фазовом исключении высокомолекулярных двухцепочечных ДНК (мол. масса более 20х106 Да) из водно-полимерных или водно-солевых растворов, образуются единичные частицы, имеющие форму торов (бубликов) диаметром около 1000 А, а иногда и другие пространственные структуры [4]. Получены также доказательства, что в составе торов соседние участки единичной молекулы ДНК уложены упорядоченно, однако вопрос о том, какому состоянию соответствует эта упорядоченная упаковка, остается дискуссионным [5, 6].
Экспериментальное изучение процесса конденсации единичных молекул ДНК затруднительно, поскольку наблюдать его можно только при помощи электронного или атомно-силового микроскопов, причем опыты необходимо проводить с растворами, в которых концентрация нуклеиновых кислот не превышает 0.1 мкг/мл, и в условиях, исключающих повреждение вторичной структуры этих молекул. Неудивительно, что опубликовано сравнительно немного работ (см., например, [2, 6]), содержащих убедительные доказательства образования торообразных частиц ДНК.
Жидкокристаллическое состояние низкомолекулярных двухцепочечных ДНК. Параллельно и практически независимо развивалось исследование конденсации двухцепочечных молекул ДНК, молекулярная масса которых не превышала 106 Да. Очевидно, что при использовании линейных, жестких молекул ДНК конденсация - это межмолекулярный процесс, в результате которого можно получить фазу (осадок) или изолированные частицы фазы (дисперсию) ДНК (рис. 1). Изучение свойств фазы, или дисперсии, существенно облегчается, поскольку имеются не только экспериментальные методы наблюдения за их образованием, но и параметры, позволяющие классифицировать фазы (дисперсии).
Рис. 1. Схематическое изображение линейных молекул ДНК (а), схема фазового исключения из водно-солевого раствора и частица холестерической жидкокристаллической дисперсии ДНК (б), расположение двухцепочечных молекул ДНК в слое холестерика (в) D - диаметр холестерика, около 103 А, Р - шаг спиральной закрутки холестерика (данные С.Г. Скуридина)В 1961 г. физикохимик К. Робинсон, исследуя при помощи поляризационного микроскопа свойства тонкого слоя концентрированного раствора ДНК, наблюдал характерную картину, известную под названием "текстура отпечатков пальцев", которая аналогична текстуре тонких слоев растворов поли-g-бензил-L-глютамата в органических растворителях. Опасаясь присутствия белковых примесей в растворе, Робинсон осторожно сформулировал предположение о том, что молекулы ДНК в концентрированных растворах могут находиться в жидкокристаллическом (мезофазном) состоянии. Позднее были проведены микроскопические и рентгенографические исследования, которые не только подтвердили это предположение, но и доказали множественность фаз молекул ДНК длиной около 500 А, возникающих при фазовом исключении в разных условиях (см., например, [7,8]).
Фрагменты двухцепочечной ДНК длиной около 500 А ведут себя в водно-солевых растворах как жесткие стержни. Поскольку в водно-солевых растворах умеренной ионной силы (~0.1 М NaCI) среднее значение эффективного диаметра (D) ДНК близко к 50 А, у молекулы длиной L ~ 500 А аксиальное отношение (L/D) составляет примерно 10. Согласно расчетам, жесткие молекулы, обладающие такими параметрами, стремятся к образованию упорядоченной фазы при концентрировании. Фазовый переход ДНК удовлетворительно описывается в рамках теории П. Флори для жесткоцепных полимеров.
Обобщив результаты, полученные многими исследователями, выделим основные фазы, наблюдаемые при концентрировании двухцепочечных молекул ДНК (таблица). При некоторой, так называемой критической, концентрации молекулы ДНК спонтанно конденсируются, формируя фазу с характерным расстоянием между молекулами от 51 до 30 А. Две особенности присущи этой фазе. Как следует из рентгенограмм, молекулы ДНК в образующейся фазе упорядочены, однако трехмерный порядок в их расположении отсутствует, то есть для фазы характерны свойства одномерного кристалла. В то же время фаза обладает текучестью, и соседние молекулы ДНК сохраняют присущие им некоторые диффузионные степени свободы, то есть для фазы характерны свойства жидкости. Именно сочетание этих двух разных особенностей позволяет использовать термин лиотропная "жидкокристаллическая" для обозначения фазы, возникающей в результате концентрирования ДНК.
Величина критической концентрации обратно пропорциональна длине молекул ДНК. Например, для фрагмента ДНК в 147 пар нуклеотидов она составляет около 170 мг/мл, а при размере 437 пар нуклеотидов - 90 мг/мл. Величина критической концентрации прямо пропорциональна ионной силе раствора и практически не зависит от его температуры в пределах от 20 до 60°С.
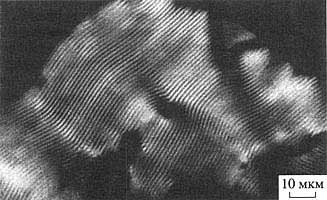
Рис. 2. Текстура тонкого слоя холестерической фазы, образованной двухцепочечными молекулами ДНК
Изображение в поляризованном свете (данные С.Г. Скуридина)Молекулы ДНК в образующейся фазе упаковываются таким способом, что в ее структуре можно выделить "слои" из соседних молекул, причем вследствие присущей молекулам ДНК анизотропии (геометрической и оптической) соседние слои повернуты относительно друг друга на небольшой угол. В результате для возникающей жидкокристаллической фазы характерна спиральная закрутка пространственной структуры; такая фаза носит название "холестерической" *. Именно в силу спиральной закрутки слоев холестерическая фаза обладает текстурой "отпечатков пальцев" (рис. 2).
* В данном случае термин "холестерическая" имеет лишь исторический смысл; этот термин был введен в 1922 г. Г. Фриделем для обозначения одного из классов жидких кристаллов, к которому относились, главным образом, производные холестерина. Особенность этого класса жидких кристаллов состоит в том, что в каждом последующем слое длинные оси молекул повернуты на небольшой угол по отношению к предыдущему, что приводит к образованию макроскопической спиральной структуры.Интересен вопрос о направлении закрутки пространственной структуры холестерической фазы двухцепочечных молекул ДНК. Прямые измерения оптических свойств концентрированных растворов ДНК при помощи так называемого клина Гранжана-Кано показали, что при концентрации около 200 мг/мл правоспиральные двухцепочечные молекулы ДНК формируют холестерик, в котором соседние слои закручены влево. Обычно говорят, что правые молекулы ДНК образуют холестерик с левой закруткой пространственной структуры. Отметим, что параметры вторичной структуры спиральной молекулы ДНК (расстояние между парами оснований и их ориентация относительно осей молекулы ДНК) практически не меняются при возникновении жидкокристаллической фазы. Величина шага спиральной закрутки холестерика из молекул ДНК увеличивается по мере роста концентрации ДНК, то есть при переходе от холестерической к гексагональной фазе происходит раскрутка пространственной структуры холестерической фазы ДНК, но не спирали ДНК.Таким образом, доказано, что жесткие двухцепочечные молекулы ДНК в процессе межмолекулярной конденсации образуют упорядоченные жидкокристаллические и кристаллические фазы. Следует обратить внимание на то, что приготовление концентрированных растворов ДНК с фиксированными свойствами - трудная экспериментальная задача, а сам процесс формирования жидкокристаллических фаз в такой системе может длиться недели и даже месяцы.
Сколько-нибудь последовательная и полная теории фаз, образуемых жесткими молекулами типа двухцепочечной ДНК, еще не создана, что объясняется сложностью как структуры самих молекул, так и характера их взаимодействия друг с другом и с растворителем. Если в процессе формирования жидких кристаллов низкомолекулярных соединений растворитель играет довольно пассивную роль, выступая только как переносчик электростатических или дисперсионных взаимодействий, то в случае ДНК, образующих жидкокристаллические фазы, ситуация другая. Взаимодействия молекул ДНК и растворителя, ответственные за образование жидкого кристалла, по определению не локальны, поскольку физически всегда связаны с пространственной дисперсией диэлектрических свойств. Однако эта нелокальность становится существенной лишь для сегментов ДНК длиной порядка 100 пар нуклеотидов, сильно взаимодействующих с молекулами воды. Высказано предположение, согласно которому упаковка молекул ДНК связана не только с анизотропными свойствами молекул ДНК, сближающимися в процессе фазового исключения, но и со свойствами находящихся между ними молекул воды [9]. Роль воды в стабилизации и "отражении" вторичной структуры ДНК долгое время остается предметом теоретических и экспериментальных исследований.
Что касается применения жидкокристаллических фаз ДНК для решения практических задач, то нужно отметить следующее. Несмотря на простоту самого процесса концентрирования, длительность достижения равновесного состояния, а также зависимость образования фазы от множества трудно учитываемых факторов резко ограничивают возможность практического использования этих фаз.
Жидкокристаллические дисперсии двухцепочечных ДНК. С физико-химической точки зрения, интерес к жидкокристаллическим дисперсиям обусловлен тем, что свойства частиц дисперсий размером 100-1000 А могут значительно отличаться от свойств, характерных для непрерывных фаз. Дело в том, что расположение молекул ДНК в слое задается осмотическим давлением растворителя, возможны и дефекты упаковки молекул ДНК в частицах. В результате упаковка молекул в частицах дисперсий, в принципе, может отличаться от упаковки молекул в жидкокристаллических фазах. С биологической точки зрения, свойства частиц жидкокристаллических дисперсий интересны потому, что такие частицы позволяют более точно описать свойства ДНК-содержащих вирусов или хромосом простейших. Для этих дисперсных систем микроскопического размера характерна не только упорядоченная, но и подвижная упаковка ДНК. С практической точки зрения, жидкокристаллические дисперсии привлекают внимание уникальным сочетанием физико-химических свойств молекул ДНК.
Рассмотрим свойства частиц дисперсной фазы, формируемой при смешении водно-солевых растворов ДНК с водно-солевыми растворами некоторых полимеров, в частности полиэтиленгликоля. При достижении критической концентрации полиэтиленгликоля происходит фазовое исключение молекул ДНК, приводящее к образованию дисперсии, частицы которой имеют микроскопический размер (диаметр порядка 103 А) [10]. Вторичная структура ДНК и химическая реакционная способность азотистых оснований ДНК при фазовом исключении практически не меняются.
Рентгенографический анализ свидетельствует не только об упорядоченности молекул ДНК в частицах дисперсии, но и о том, что концентрация ДНК составляет около 200 мг/мл, то есть возможно образование холестерической фазы ДНК. Доказательство существования именно холестерической жидкокристаллической упаковки молекул ДНК в частицах дисперсии основано на появлении аномальной оптической активности в полосе поглощения так называемого внешнего хромофора. (Это растворенные в расплавах термотропных холестериков молекулы окрашенного соединения, которые определенным образом ориентируются в слоях холестерической структуры).
В структуре двухцепочечных молекул ДНК имеются хромофоры (азотистые основания, поглощающие в ультрафиолетовой области спектра), которые достаточно жестко фиксированы: угол наклона оснований по отношению к длинной оси молекул ДНК - около 90°. Если при фазовом исключении образуются частицы со слоевой упаковкой молекул ДНК (см. рис. 1), то это означает, что азотистые основания также определенным образом ориентированы в слое из соседних молекул ДНК. Поэтому можно ожидать появления в спектре кругового дихроизма аномальной полосы в области поглощения азотистых оснований только при холестерической упаковке соседних молекул ДНК в образующихся при фазовом исключении частицах жидкокристаллической дисперсии.
Расчеты позволили уточнить условия (шаг спиральной структуры холестерика, размер частиц дисперсии и т. д.), при которых аномальная полоса может быть зарегистрирована экспериментально. Проведенные опыты обнаружили ее в спектрах кругового дихроизма жидкокристаллических дисперсий ДНК (рис. 3). Этот результат свидетельствует, что в частицах дисперсии жесткие анизотропные молекулы ДНК реализуют свое потенциальное стремление к холестеричес-кому способу упаковки. Очевидно, что формирование дисперсий из одноцепочечных молекул нуклеиновых кислот, для которых характерна нежесткая ориентация азотистых оснований, не может привести к появлению аномальной полосы в спектрах кругового дихроизма.
Рис. 3. Спектры кругового дихроизма линейной В-формы ДНК (1), жидкокристаллической дисперсии ДНК (2) и жидкого кристалла ДНК (3)Частицы холестерической дисперсии существуют только в определенном интервале осмотического давления растворителя, задаваемого, например, концентрацией полиэтиленгликоля в растворе. Выход за нижний предел приводит к изотропному состоянию, выход за верхний предел - к гексагональной упаковке молекул ДНК в частицах дисперсии. В ходе обоих процессов исчезает аномальная оптическая активность, что свидетельствует о весьма подвижной пространственной организации холестерика ДНК. Поскольку холестерические жидкокристаллические дисперсии ДНК формируются в водно-полимерных растворах, имеющих определенное осмотическое давление и диэлектрическую постоянную, направление закрутки пространственной холесте-рической спирали зависит от свойств растворителя [10].Взаимодействие биологически активных соединений с молекулами ДНК, входящими в состав частиц холестерической дисперсии, может менять свойства ДНК. Это, в свою очередь, означает, что при определенной структуре биологически активных молекул, взаимодействующих с ДНК, формирование дисперсий из комплексов "ДНК-биологически активное соединение" может сопровождаться изменением как величины амплитуды аномальной полосы в спектре кругового дихроизма, так и ее знака.
Модификация поверхности молекулы ДНК в результате действия физических или химических факторов, нарушающих однородность поверхности, влияет на способность молекул ДНК к образованию холестерических жидкокристаллических дисперсий. Таким образом, не только направление закрутки спирали исходной молекулы, но и свойства поверхности молекул нуклеиновых кислот имеют важное значение при определении характера их пространственной упаковки в жидкокристаллической дисперсии.
Если происходит встраивание (интеркаляция) окрашенных биологически активных соединений между парами оснований ДНК в составе частиц холестерической дисперсии, то в спектре кругового дихроизма следует ожидать появления двух аномальных полос. Одна из них будет по-прежнему расположена в области поглощения азотистых оснований ДНК (длина волны около 270 нм), другая - в области поглощения хромофоров биологически активного соединения (например, на длине волны 500 нм). Появление двух аномальных полос в спектре кругового дихроизма может быть объяснено только в том случае, если из молекул ДНК образуется жидкокристаллическая дисперсия, для частиц которой характерна холестерическая пространственная структура. В определенных условиях амплитуда полосы на длине волны 500 нм прямо пропорциональна концентрации молекул биологически активного соединения, связанных с ДНК, тогда как полоса на длине волны 270 нм остается практически неизменной; она может служить внутренним стандартом, характеризующим качество полученного холестерика.
Таким образом, свойства молекул ДНК и водно-полимерного раствора управляют свойствами частиц жидкокристаллических дисперсий. Как и в случае жидкокристаллических фаз, могут формироваться дисперсии с различной упаковкой. Однако упаковка молекул ДНК в частицах жидкокристаллических дисперсий легко регулируется, что сближает их поведение с поведением биологических объектов.
Жидкокристаллическое состояние ДНК в биологических системах. Тот факт, что оптически активные молекулы ДНК при высокой концентрации должны находиться в жидкокристаллическом состоянии, позволяет высказать предположение о реальности существования такого состояния in vivo [11]. Действительно, при исследовании сборки бактериофага Т4 в клетках Е. coli было показано, что на определенной стадии происходит расщепление белка р22 на два низкомолекулярных белка II и VII, в составе которых содержание остатков глутаминовой и аспарагиновой кислот достигает 80 и 48% соответственно. Эти белки в клетке несут суммарный отрицательный заряд, поэтому не могут образовать комплексов с ДНК. Концентрация низкомолекулярных белков в месте сборки фаговой частицы составляет примерно 500 мг/мл, то есть в клетках Е. соli создаются те же условия, что и в водно-солевых растворах полиэтиленгликоля (ПЭГ) при фазовом исключении. Такая ситуация названа ПЭГ-подобной. Прямыми опытами было доказано, что в этих условиях водорастворимые биополимеры вызывают фазовое исключение молекул ДНК.
Электронно-микроскопическое исследование ультратонких срезов хромосом жгутиконосцев (Dinoflagellata) под разными углами их сечения выявило молекулярные узоры, математическая реконструкция которых однозначно отражает холестерическую упаковку молекул ДНК в этом биологическом объекте (рис. 4). Аналогичные молекулярные узоры наблюдались также на срезах хромосом бактерий (Escherichia coli, Bacillus subtilis, Rhizobium, etc.), однако их редко интерпретировали как указание на холестерическую упаковку ДНК.
а - схема хромосомы, Р/2 - расстояние между двумя светлыми (или темными) полосами на текстуре; б - направление срезов ультратонких слоев хромосомы; в - схема сечения под произвольным углом к длинной оси хромосомы (7), перпендикулярно к ней (2) и вдоль длинной оси (3)
Если учесть высокую плотность упаковки генетического материала, то следует признать, что в некоторых биологических объектах преобладает холестерическое жидкокристаллическое состояние молекул ДНК. Конечно, в вирусах и хромосомах упаковка двухцепочечных молекул ДНК или их сегментов может быть разной. В тех случаях, когда молекулы ДНК практически не связаны с белками (бактериальные нуклеоиды, хромосомы простейших, вирусы и т.д.), реализуется упорядоченная упаковка жидкокристаллического или кристаллического типа. При этом анизотропные свойства молекул ДНК обеспечивают формирование холестерической упаковки, наблюдаемой экспериментально.
В клетках высших организмов, где молекулы ДНК связаны с гистонами и другими белками, реализуется другой способ упаковки ДНК. По аналогии с жидкокристаллической дисперсией ДНК, можно предположить, что белки, входящие в состав хроматина, играют роль диэлектрической среды, влияющей на способ упаковки молекул ДНК. Кроме того, взаимодействие ДНК с гистоновыми и другими белками приводит к возникновению структур, называемых нуклеосомами [12]. В фибриллах, образуемых нуклеосомами, молекулы ДНК упаковываются в более сложную спиральную структуру, свойства которой заметно отличаются от свойств структуры, наблюдаемой в концентрированном растворе. Такая структура может включать упорядоченные и неупорядоченные элементы, а также "петли". Таким образом, в клетках высших организмов может существовать иерархия структур, определяемая не только содержанием и свойствами белков, но и пространственными особенностями нуклеосом. С переходом между этими иерархическими структурами связана реализация генетической информации в организмах. Тем не менее внутреннее (фазовое) поведение ДНК и в этом случае аналогично поведению жидкокристаллической фазы, поскольку определяется стремлением молекул ДНК к упорядоченной упаковке.
Практическое применение частиц жидкокристаллических дисперсий ДНК. Как известно, частицы жидкокристаллических дисперсий используются в качестве чувствительных элементов (биодатчиков) биосенсорных устройств [1] и как "депо" генетического материала или биологически значимых соединений, способных к образованию комплексов с ДНК.
Последнее десятилетие характеризуется интенсивным развитием технологий, которые ориентированы на создание устройств, позволяющих получать информацию о свойствах различных сред (объектов) в форме электрического сигнала. В сенсорных технологиях чувствительный элемент способен "узнать" исследуемое вещество среди множества родственных и преобразовать полученную информацию о его присутствии в ответ, фиксируемый в цифровой или аналоговой форме. Наибольшее развитие имеют аналитические устройства, использующие в качестве узнающего элемента биомакромолекулы - биосенсоры. В простейшем случае биосенсор состоит из биодатчика, который содержит молекулы, способные к узнаванию, и преобразователя, трансформирующего любой сигнал (о массе, цвете, концентрации ионов и т. д.), который генерируется при взаимодействии биодатчика с анализируемым веществом, в электрический.
Создание биосенсоров - задача биоинженерии, решаемая на основе достижений современной молекулярной биологии, физической химии биополимеров и микроэлектроники. Теоретически любая биологическая молекула (или биохимическая реакция) может быть использована при конструировании биодатчиков. Однако анализ данных литературы показывает, что в большинстве разработанных к настоящему времени биосенсоров чувствительными элементами служат ферменты (белки). Менее распространены биодатчики на основе одноцепочечных нуклеиновых кислот и полинуклеотидов. Мы уделим внимание только биодатчикам, использующим жидкокристаллические дисперсии ДНК. Они разработаны в нашей лаборатории [11], нами получены патенты России, США, Германии и других стран.
Принцип действия биодатчика на молекулах двухцепочечных ДНК основан на высокой лабильности холестерической структуры жидкокристаллических дисперсий ДНК. Уже отмечалось, что нарушение регулярного характера расположения азотистых оснований или модификация поверхности молекул ДНК под действием разных факторов влияют как на способность молекул ДНК к формированию холестерических жидкокристаллических дисперсий, так и на оптические свойства самих дисперсий.
Действительно, образование "сшивок" между парами азотистых оснований, например, при действии противоопухолевых соединений группы платины(II), сопровождается нарушением взаимной ориентации соседних оснований. В результате амплитуда аномальной отрицательной полосы в спектре кругового дихроизма, характерная для холестериков из молекул ДНК (см. рис. 3), резко уменьшается. Появление одной "сшивки", содержащей один атом платины и приходящейся приблизительно на 100 пар оснований, оказывается достаточным, чтобы заметно подавить аномальные оптические свойства холестерической дисперсии ДНК.
Тот же эффект вызывают фотохимическая модификация ДНК под действием ультрафиолетового облучения (образование тиминовых димеров), а также создание на поверхности молекул ДНК "выступов" (протуберанцев) в результате взаимодействия азотистых оснований с комплексными соединениями металлов и последующего формирования холестерической дисперсии. Последний способ позволяет обнаружить эффект воздействия на ДНК приблизительно одного атома меди на 100 пар азотистых оснований или одного атома палладия на 500 пар.
Принцип действия биодатчиков, использующих частицы жидкокристаллической дисперсии, состоит в следующем: азотистые основания в молекулах ДНК, фиксированных в структуре холестерической жидкокристаллической дисперсии, тем или иным способом "узнают" молекулы биологически активного соединения (БАС) и "адресуют" их в определенные места на поверхности ДНК. Образование комплекса "ДНК-БАС" приводит к появлению первичного (в частности, оптического) сигнала. Пространственная структура холестерика многократно усиливает генерируемый в системе первичный сигнал (пространственная амплификация сигнала) и делает видимыми результаты действия биологически активного соединения на ДНК: в спектре кругового дихроизма появляется аномальная полоса (полосы) в области поглощения биологически активного соединения. Амплитуда этой полосы пропорциональна концентрации биологически активного соединения, а знак полосы несет информацию о способе ориентации его молекул по отношению к парам оснований ДНК.
На рис. 5, а приведены спектры кругового дихроизма жидкокристаллических дисперсий ДНК, обработанных дауномицином - окрашенным противоопухолевым антибиотиком антрациклиновой группы. В этих спектрах, кроме отрицательной полосы в области поглощения азотистых оснований ДНК (длина волны около 270 нм), наблюдается дополнительная отрицательная полоса в диапазоне поглощения дауномицина (длина волны около 500 нм). Отрицательный знак однозначно свидетельствует о том, что молекулы дауномицина интеркалируют между парами оснований ДНК. Интересно, что амплитуда полосы на длине волны 270 нм практически не меняется при увеличении концентрации дауномицина в растворе, в то время как амплитуда полосы на длине волны 500 нм прямо пропорциональна концентрации молекул дауномицина, связанных с ДНК. Пользуясь калибровочной зависимостью (рис. 5, б), можно определять концентрацию дауномицина в растворе.
Рис. 5. Спектр кругового дихроизма в ультрафиолетовой (длина волны 270 нм) и видимой (длина волны 500 нм) областях спектра для жидкокристаллической дисперсии ДНК. обработанной дауномицином (а), и зависимость амплитуды отрицательной полосы в видимой области спектра от концентрации дауномицина (б) Светлые и темные точки на кривой (б) - результаты, полученные сразу и через 12 часов после добавления дауномицина (данные В.И. Салянова)
Таким же способом можно обнаруживать (даже в плазме крови) другие противоопухолевые соединения - синтетические и полусинтетические антибиотики антрациклинового ряда (карминомицин, аклациномицин, виоламицин и т. д.), антраценового (бисантрен) или антрахинонового рядов (митоксантрон). Минимальные концентрации этих соединений, определяемые биодатчиками на жидкокристаллических дисперсиях ДНК (около 10-7 M), соответствуют реальным концентрациям, которые применяются при терапии опухолевых заболеваний. Следовательно, при помощи жидкокристаллических дисперсий можно не только выявить биологически активное соединение и определить его концентрацию, но и установить способ расположения его молекул на ДНК [11], что представляет интерес при синтезе новых производных биологически активного соединения.
Новейшее направление биоинженерии - создание сложных трехмерных конструкций с регулируемыми свойствами, "строительными блоками" которых являются молекулы ДНК. Предложенный сотрудниками нашей лаборатории совместно с коллегами из Германии и Италии подход к построению молекулярных конструкций на основе жидкокристаллических дисперсий ДНК основан на пространственной фиксации молекул ДНК при помощи "сшивок", содержащих в своем составе "чувствительные элементы" с регулируемыми свойствами [14].
"Сшивание" независимо диффундирующих соседних молекул ДНК, расположенных в частицах жидкокристаллических дисперсий на расстоянии 30-50 А друг от друга, представляет определенную трудность, поскольку необходимо сохранить целостность пространственной структуры частицы холестерической дисперсии и не нарушить ее аномальную оптическую активность. Молекулярное конструирование базируется на нескольких положениях, прямо вытекающих из свойств жидкокристаллических дисперсий.
Во-первых, химическая реакционная способность молекул ДНК не нарушается, что открывает возможность для направленного изменения их свойств. В частности, на поверхности молекул ДНК можно регулярным образом фиксировать различные соединения (молекулы "гостей").
Во-вторых, скорость химических реакций, как правило, выше скорости диффузионного перемещения соседних молекул ДНК.
И, в-третьих, многие соединения могут образовывать структуры достаточно протяженного размера (полимерные хелатные комплексы, жесткие или полужесткие линейные структуры и т. д.). Для создания "сшивок" использовались ант-рациклиновые антибиотики, например дауноми-цин и его аналоги.
Наиболее просто построить молекулярную конструкцию на основе двухцепочечных полирибонуклеотидов, так как интеркаляция антрациклинов между парами азотистых оснований не нарушает структуру этих молекул. Предложенная нами полимерная хелатная "сшивка" между молекулами поли(И) х поли(Ц), фиксированными в частице жидкокристаллической дисперсии, показана на рис. 6, а. Возникновение полимерных хелатных "сшивок" [ДАУ-Сu2+-ДАУ-Сu2+....ДАУ-Сu2+-ДАУ] между соседними молекулами поли(И) х поли(Ц) приводит к образованию трехмерной молекулярной конструкции (рис. 6, б).
Рис. 6. Полимерный хелатный мостик между соседними молекулами поли(И) х поли(Ц), фиксированными в структуре частицы холестерической жидкокристаллической дисперсии (а - вид вдоль длинной оси соседних молекул), и трехмерная молекулярная конструкция на основе двухцепочечных молекул нуклеиновых кислот, фиксированных в структуре частицы жидкокристаллической дисперсии и сшитых полимерными хелатными мостиками (б) D - расстояние между слоями молекул ДНК, n - направление закрутки слоя (данные М.А. Захарова)Если энергия "сшивок" достаточна для фиксации соседних молекул нуклеиновых кислот, то осмотическое давление водно-полимерного раствора уже не столь существенно для стабилизации структуры частиц, то есть создаются условия, в которых частицы жидкокристаллических дисперсий могут существовать без нарушения их исходной холестерической структуры даже в обычном водно-солевом растворе. Появляется возможность для прямого определения формы и размера микроскопических частиц жидкокристаллических дисперсий после их превращения в пространственно зафиксированную молекулярную конструкцию. Согласно данным атомной силовой микроскопии, в молекулярных конструкциях, сформированных на основе молекул поли(И) х поли(Ц), средний размер частиц, имеющих форму, близкую к сферической, - около 0.4 мкм [14]. Размер частиц молекулярной конструкции ДНК меняется в пределах от 0.3 до 0.7 мкм, однако их средний размер (около 0.5 мкм) вполне согласуется с результатами определения размера частиц жидкокристаллических дисперсий ДНК, полученными другими физико-химическими методами.Созданная нами молекулярная конструкция уникальна, поскольку любой из компонентов полимерных хелатных "сшивок" может служить "чувствительным элементом". Нарушение целостности структуры в одном месте или изменение конфигурации полимерных хелатных "сшивок" между молекулами нуклеиновых кислот приведет в конечном счете к разрушению всей молекулярной конструкции. Этот процесс должен сопровождаться уменьшением аномальной оптической активности. В определенных условиях величина амплитуды аномальной полосы в спектре кругового дихроизма молекулярной конструкций прямо связана с концентрацией химического или биологически активного соединения, разрушающего полимерную хелатную "сшивку". Таким образом, молекулярная конструкция на основе жидкокристаллических дисперсий нуклеиновых кислот представляет собой биодатчик микроскопического размера для определения любого фактора, влияющего на стабильность полимерной хелатной "сшивки". Этот биодатчик, в принципе, можно назвать интегральным микрочипом [14].
Молекулярная конструкция может разрушаться в результате восстановления ионов Сu2+ до Сu1+ или при действии на молекулярную конструкцию "суммарного" белка или индивидуальных белков (инсулин, пепсин, бычий сывороточный альбумин. РНКаза, g-глобулин, лизоцим), а также полиаминокислот (полигистидин, полилизин, полиглютаминовая кислота или полиаспарагиновая кислота). Разрушение обусловлено образованием более прочных комплексов между белками (аминокислотами) и ионами Сu2+ и, следовательно, уходом ионов Сu2+ из состава полимерной хелат-ной "сшивки". Наличие прямо пропорциональной зависимости между изменением амплитуды полосы в спектре кругового дихроизма молекулярной конструкции [14] и, в частности, концентрацией биологически активного соединения в растворе в интервале от 0 до 12 мкг/мл позволяет использовать эту зависимость для определения содержания биологически активного соединения.
Существует принципиальная возможность повышения эффективности процесса "сшивания" соседних молекул нуклеиновых кислот за счет создания на их поверхности дополнительных реакционных мест, способных к хелатообразованию. Действительно, можно нейтрализовать отрицательные заряды фосфатных групп на поверхности нуклеиновых кислот, сформировав электростатический комплекс между нуклеиновыми кислотами и спиральными полимерами, несущими, например, такие реакционные группы, как гидроксильная или аминогруппа. В силу спиральной структуры молекул нуклеиновых кислот не все аминогруппы полимера будут принимать участие в нейтрализации зарядов фосфатных групп. Часть аминогрупп будет "экспонирована" в растворитель. Сочетание гидроксильной и аминогруппы в составе полимера позволит формировать хелатные комплексы с ионами двухвалентных металлов. Эти хелатные комплексы могут служить местом "начала" или "окончания" полимерных мостиков, сшивающих в данном случае не молекулы нуклеиновых кислот, а молекулы "чужеродных" полимеров. Открывается возможность для создания нового типа биодатчиков.
Поскольку локальная концентрация ДНК в частицах жидкокристаллических дисперсий может достигать сотен миллиграммов в одном миллилитре, эти частицы могут использоваться для введения генетического материала в клетки, а значит, и трансформации клеток. Кроме того, локальная концентрация противоопухолевых соединений, антибиотиков и т.д., способных связываться с ДНК в составе частиц дисперсий, всего в несколько раз меньше локальной концентрации ДНК, что открывает возможность для введения весьма высоких концентраций антибиотиков в клетки животных.
Таким образом, исследование особенностей жидкокристаллического состояния двухцепочечных молекул ДНК позволяет не только расширить спектр свойств этих молекул, важных с теоретической и практической точек зрения, но и осознать существование разрыва при переносе знаний, полученных в процессе изучения свойств изолированных молекул ДНК, на свойства конденсированных молекул ДНК в составе биологических объектов.
Работа поддержана грантами РФФИ (проект № 01-04-48262 и проект № 03-04-48212),
международными грантами,
грантами в рамках программы "Новейшие методы биоинженерии" (контракт №43.073.1.1.2505),
а также грантами компании "Биоаналитические технологии" (Москва).Литература
1. Варфоломеев С.Д., Евдокимов Ю.М., Островский М.А. Сенсорная биология, сенсорные технологии и создание новых органов чувств человека // Вестник РАН. 2000. № 2.
2. Vasilevskaya V.V. et al. Collapse of single DNA molecule in poly(ethylene glycol) solutions // J. Chem. Phys. 1995. V. 102. P. 6595-6602.
3. Wissenburg P. et al. Multimolecular aggregation of monosomal DNA in concentrated isotropic solutions // Macromolecules. 1995. V. 28. P. 2315-2328.
4. Golo V.L., Kats E.I., Yevdokimov Yu.M. Toroidal structures due to anisotropy of DNA-like molecules // J. Biomolecular Structure & Dynamics. 1998. V. 15. P. 757-764.
5. Golo V.L., Yevdokimov Yu.M., Kats Е.I. Effect of elec-troelastic anisotropy of DNA-like molecules of their ternary structure // J. Expt. Theor. Phys. 1997. V. 85. P. 1180-2286.
6. Vasilevskaya V.V. et al. Structure of collapsed persistent macromolecule: toroid vs. spherical globule // Biopolymers. 1997. V. 41. P. 51-60.
7. Rill R. et al. Ordered phases in concentrated DNA solutions // Physica A. 1991. V. 176. P. 87-116.
8. International Interdisciplinary Workshop: "Structure and function of DNA. A physical approach" // 1996, September 30-October 5. Abbay du Mont Sainte-Odile, Alsace, France.
9. Голо B.Л. и др. Взаимодействие сегментов нуклеиновых кислот вследствие модификации сети водородных связей растворителя // ЖЭТФ. 2000. Т. 118. С. 959-972.
10. Евдокимов Ю.М. и др. Стабилизация оптических свойств частиц холестерических жидкокристаллических дисперсий ДНК // Биофизика. 1998. Т. 43. С. 240-252.
11. Скуридин С.Г., Евдокимов Ю.М. Частицы жидкокристаллических дисперсий ДНК как основа для создания чувствительных элементов биосенсоров // Биофизика. 2003 (в печати).
12. Карпов B.Л. ДНК, хроматин, гистоновый код // Вестник РАН. 2003. № 6.
13. Евдокимов Ю.М. и др. Молекулярные конструкции (суперструктуры) с регулируемыми свойствами на основе двухцепочечных нуклеиновых кислот // Молекулярная биология. 2003. Т. 37. С. 1-16.
14. Yevdokimov Yu.M., Salyanov V.I., Zakharov М.А. A novel type of microscopic size chip based on double-stranded nucleic acids // Lab on a Chip. 2001. V. 1. P. 35-41.