том 73, № 2, с. 99-109 (2003)
| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
том 73, № 2, с. 99-109 (2003) |
Подписание в 1972 г. Международной конвенции по биологическому оружию положило запрет на производство, распространение и применение биологического оружия массового поражения. Однако последние достижения биологии в корне изменили представления о биологическом оружии: были созданы генные конструкции, способные инициировать нарушение метаболизма и гибель клеток. Современным средствам защиты от биологических атак было посвящено выступление автора публикуемой ниже статьи на расширенном пленарном заседании научного совета при Совете безопасности Российской Федерации, приуроченном к 10-летию образования Совета безопасности.О БИОЛОГИЧЕСКОЙ БЕЗОПАСНОСТИ М. А. Пальцев
Пальцев Михаил Александрович - академик, заместитель академика-секретаря,
руководитель Секции физиологии Отделения биологических наук РАН,
ректор Московской медицинской академии им. И.М. Сеченова.Биологическая безопасность государства связана с разработкой средств защиты от биологического оружия и с возможностью предотвращения биотеррористических атак. Поэтому особое значение приобретает изучение механизмов действия на организм человека различных агентов, которые могут использоваться в качестве биологического оружия, и прежде всего биологически активных веществ.
На протяжении второй половины XX столетия представления о том, как биологически активные вещества воздействуют на организм человека, претерпели значительные изменения. После открытия в 30-х годах фосфорорганических соединений их действие рассматривалось преимущественно на уровне целого организма (рис. 1). В послевоенный период для создания средств биологической атаки потребовалось исследование клеточных механизмов действия биологически активных веществ. Тогда были открыты сигнальные молекулы, передающие токсические сигналы внутри клетки-мишени [1]. Однако оставались неясными механизмы влияния биологически активных веществ на наследственный аппарат клетки. Успех теоретической и практической молекулярной биологии позволил определить основу процессов жизнедеятельности: от ДНК - материального носителя генов (единиц наследственной информации) до РНК - передаточного звена между ядром клетки и цитоплазмой, между наследственным аппаратом и биологическими эффектами. Окончанием этой цепочки является белок - эффективное звено. К настоящему времени известно 80 тыс. белков человеческого организма, которые производят желательные физиологические эффекты [2]. Прямое регуляторное воздействие на это звено стало возможным в результате осуществления программы "Геном человека" [3]. Избирательное включение и выключение отдельных звеньев наследственного аппарата - реальность наших дней. Действие "генетического" оружия как раз и заключается в блокировании важного для нормальной жизнедеятельности гена-регулятора или введении гена-агрессора (см. рис. 1).
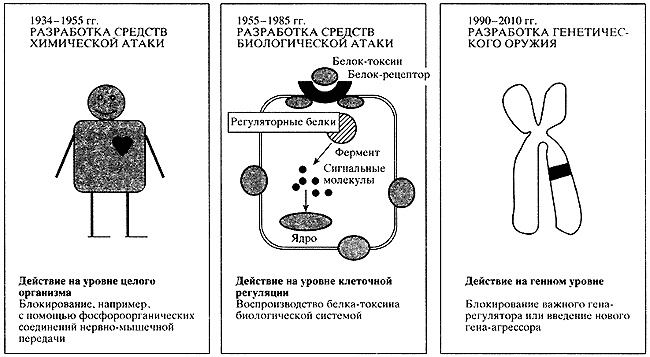
Рис. 1. Эволюция биологического оружия
Правительства ведущих стран мира выражают серьезную озабоченность по поводу возможного применения экстремистами возбудителей опасных инфекций, способных в кратчайшие сроки вызвать массовые эпидемии. В последнее время проблемам биологической безопасности уделяется большое внимание и в России. В частности, широко известны выступления и публикации академика А.С. Спирина на эту тему [4]. Но только после трагических событий II сентября 2001 г. в США и последовавшего за ними "почтового" биотерроризма отношение населения к предостережениям ученых изменилось кардинальным образом. В США и Европе интенсивно скупаются сильнодействующие антибиотики и средства индивидуальной защиты. Проблема эффективного обнаружения возбудителей опасных инфекционных заболеваний успешно решается с помощью моноклональных антител к различным антигенам этих микроорганизмов [5]. В настоящее время для иммунологической диагностики доступно большинство агентов, представляющих потенциальную опасность для населения.икроколонка
Известно, например, что споры сибирской язвы в процессе заражения проникают глубоко в легкие, превращаются в вегетативную форму и поражают грудные лимфатические узлы. Способность В. anthracis быстро размножаться и убивать пациента обусловлена секрецией двух факторов вирулентности: полимерной капсулы и сибиреязвенного экзотоксина (рис. 2). Экзотоксин состоит из трех белков: протективного антигена (ПА), летального (ЛФ) и отечного факторов (ОФ). По отдельности эти белки безвредны, они проявляют токсичность только после связывания с клетками и кооперативного взаимодействия между собой. Первоначально протективный антиген связывается с рецептором на плазматической мембране, затем происходит его активация путем органического протеолиза. В дальнейшем семь молекул протективного антигена образуют кольцевую структуру - гептамер, которая захватывает летальный и отечный факторы и транспортируется внутрь клетки в виде эндосомы. Слабокислая эндосомальная среда вызывает изменения структуры комплекса ПА-ЛФ^-ОФ, и выброс летального и отечного факторов в цитозоль. Отечный фактор - Са^ кальмодулин-независи-мая аденилатциклаза - драматически влияет на контроль транспорта ионов и воды через клеточные мембраны: происходит отек и гибель клеток. Механизмы токсического действия летального фактора пока неизвестны [6].
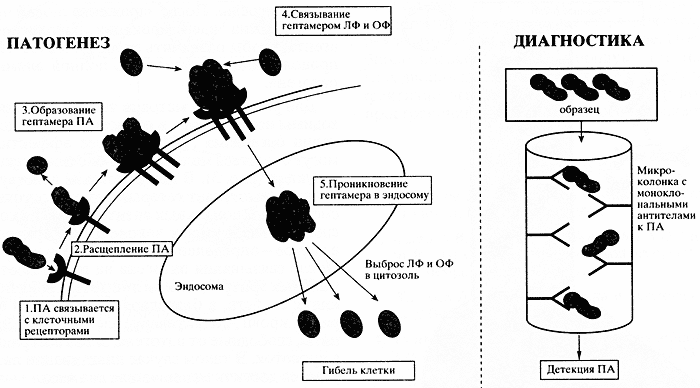
Рис. 2. Патогенез и диагностика сибирской язвы
ПА - протективный антиген; ЛФ - летальный фактор; ОФ - отечный факторДля диагностики сибирской язвы разработан быстрый иммунофильтрационный тест, который позволяет с помощью моноклональных антител детектировать 100 пкг/мл протективного антигена в сыворотке или плазме крови всего за 10 минут. Методами молекулярной иммунологической диагностики можно определить достаточно большое число опасных бактерий и вирусов, в том числе возбудителей таких заболеваний, как чума, туляремия, оспа, ботулизм, вирусная геморрагическая лихорадка, гепатиты типа А, В и С, грипп типа А и В, аденовирусные инфекции, холера, дифтерия, сальмонеллез.
В качестве потенциального средства биотеррористической атаки в настоящее время рассматриваются не только и не столько микроорганизмы - возбудители особо опасных инфекций, сколько модифицированные гены в совокупности с различными способами их введения в организм человека. Главные признаки генетического оружия: медленные темпы воздействия, высокая специфичность, абсолютная физиологичность эффекта, неконтролируемость применения и производства, многообразие средств доставки.
На основании подробных карт генома, составленных в ходе реализации проекта "Геном человека", и данных о белках стало возможным развитие самых разнообразных методов, имеющих своей целью избирательное воздействие на генетический аппарат. В частности, уже получили широкое распространение работы по доставке фрагментов определенных генов к значимым участкам хромосом. Исследования по избирательному "включению" и "выключению" функционально важных генов постепенно входят в медицинскую практику, что означает возникновение принципиально нового подхода к созданию биологически активных веществ, избирательно влияющих на различные участки генома у разных групп населения [7,8].
В современных условиях экстремистская группировка на базе небольшой лаборатории может разработать средства, избирательно замещающие нормальные гены или активирующие "гены-агрессоры", неконтролируемая деятельность которых в организме человека чревата самыми серьезными последствиями. Среди наиболее значимых "генов-агрессоров" следует выделить гены, отвечающие за развитие летальных изменений в органах дыхания, при гипертонической болезни и онкологических заболеваниях. Таким образом, уровень биотехнологии позволяет создать искусственные генетические конструкции, вызывающие патологическое состояние.
Понятие "генов-убийц", способных в результате своей экспрессии (или ее отсутствия) оказывать разрушительное влияние на жизнедеятельность организма, служит теоретической основой, на которой будет разрабатываться биологическое оружие нового поколения. Особое внимание следует обратить на гены, кодирующие белки, которые контролируют развитие программированной смерти клеток (апоптоз) [9]. Ключевой механизм апоптоза - регулирование с участием белков семейства Всl-2 деградации ДНК. В ответ на пришедший в клетку сигнал могут быть наработаны белковые продукты двух основных генов - bах и bcl-2. В первом случае это приведет к необратимым изменениям, заканчивающимся гибелью клетки, во втором - обеспечит ее дальнейшее "бессмертное" существование.
Недавно удалось вызвать смерть раковых клеток путем дополнительного введения в составе генетической конструкции свободных копий гена bах, что открывает значительные перспективы в генной терапии разных видов рака. При создании генетической конструкции использовался хорошо известный ретровирус, способный легко проникать в человеческие клетки. Определенными манипуляциями вирус был лишен возможности к размножению и дальнейшему распространению. В то же время не исключена ситуация, в которой будет применен немодифицированный вирус, способный к размножению. Это может привести к неконтролируемому попаданию гена bax в здоровые органы и ткани человека. Кроме того, введение в организм человека немодифицированного вируса может вызвать эпидемию, против которой окажутся неэффективными обычные методы профилактики и лечения [10].
Для переноса генов внутрь клетки используются физические и биологические средства доставки [11]. К физическим средствам доставки относят прямые инъекции ДНК в клетку. Такой сцособ достаточно распространен при вакцинации и иммунотерапии рака. Биологические способы доставки подразумевают создание биологических векторов на основе ретровирусных, лентиви-русных, аденовирусных и парвовирусных систем. Одним из наиболее вероятных объектов исследования может стать вирус гриппа, обладающий очень высокой изменчивостью, в том числе и вполне доступные вакцинные штаммы, например H1N1 и H3N2.
Изменчивость вируса гриппа предполагает и самопроизвольное возникновение опасных для здоровья человека вариантов, таких, например, как H5N1 и H5N7, вызвавших в 1997 г. в Гонконге эпидемию гриппа с летальностью до 40%. В этом варианте изменен участок селективного протеолиза гемагглютинина, что значительно увеличивает скорость протеолиза и проникающую спо-собность вирусных частиц. Кроме того, ген РВ-1, который кодирует белок, подавляющий клеточное дыхание, индуцирует снижение иммунитета заболевших людей и гибель иммунных клеток - макрофагов [12].
Исследования в области борьбы с биотерроризмом ведутся в нескольких направлениях. Прежде всего необходим контроль за состоянием окружающей среды. С этой целью создаются детекторы биологических субстанций [13]. В случае биотеррористической атаки должны осуществ-ляться учет и специфическая идентификация агентов путем изучения их геномов. Потребуется разработка неспецифических антисептических препаратов нового поколения для очистки окружающей среды. После заражения людей чрезвычайно важна идентификация патологического агента, чтобы назначить специфическое лечение, продолжающееся вплоть до полной элиминации патогена.
Для разработки методов такого лечения необходимы исследования в области быстрой детоксикации организма [14]. Наиболее эффективными могут оказаться молекулярно-биохимические конструкции (рис. 3). В них основным действующим началом выступает гетерополимер, состоящий из смеси моноклональных антител, одно из которых специфически узнает человеческие эритроциты, а другое - определенный возбудитель или токсин. После связывания патогена на поверхности нормальных эритроцитов он лишается своих поражающих свойств, а благодаря естественной фильтрации крови - инактивируется в печени. Эритроциты, свободные от патогена, вновь возвращаются в кровоток. В таком случае инактивации патогена удается достичь менее чем за два часа.
рис. 3. Молекулярно-биологическая конструкция для детоксикации патогенов 1- эритроциты с поверхностным антигеном,
2 - патогенный агент,
3 - гетерополимер, содержащий два типа антител,
4, 5 -антитела, узнающие соответственно патогенный агент и поверхностный антиген эритроцита
Другой метод специфической терапии обусловлен тем, что в клетках человека, пораженных инфекционным агентом, наряду с нормальной человеческой присутствует и чужеродная РНК, что, в свою очередь, вызывает прогрессирующую наработку патогенных белков. Можно заблокировать действие чужеродной РНК, что в итоге приведет к выздоровлению [15]. Неконтролируемое же накопление РНК в клетках чревато самыми серьезными последствиями вплоть до смерти больного.
В интересах биологической безопасности России чрезвычайно актуальна разработка новых средств профилактики опасных инфекционных заболеваний. Туберкулез занимает в их ряду одно из первых мест в силу низкой эффективности традиционно используемой в нашей стране вакцины БЦЖ. Ее низкая эффективность объясняется устойчивостью бактериальной клетки к антибиотикам [9].
Биология бактериальной клетки предполагает выраженную эволюционную изменчивость в зависимости от условий внешней среды. При воздействии антибиотиков на бактериальную популяцию остаются в живых лишь те экземпляры, которые могут выбрасывать из клетки токсичное лекарство с помощью специального насоса, расщеплять новый антибиотик или модифицировать его в нетоксичную форму. Все эти признаки генетически закреплены и передаются от выживших особей потомкам. Ситуация осложняется особенностью бактериальной жизнедеятельности, связанной с тем, что бактерии способны осуществлять генетический обмен, приобретая друг от друга эволюционно устойчивые гены.
Именно поэтому на смену вакцине БЦЖ должны прийти биопрепараты, имеющие в своей основе новые высокоочищенные протективные антигены. К ним в первую очередь относятся белки "теплового шока" (HSP) [16]. Эффективность вакцинации против туберкулеза существенно возрастает при использовании отдельных представителей этой группы белков. Существуют методические подходы для получения генетических конструкций на основе генов теплового шока (рис. 4). В результате получается полифункциональная плазмида, годная как для дальнейшего введения в бактерию-продуцент и наработки чистого рекомбинантного антигена, так и для ДНК-вакцинации, когда генетическая конструкция вводится непосредственно в организм человека, вызывая наработку специфических антител против протектив-ного антигена [17].
Рис. 4. Генетическая конструкция, созданная на основе гена теплового шока 1- гены теплового шока (HSP-70, HSP-65, HSP-10),
2 - плазмида со встроенными генами теплового шока
Внедрение компьютерных технологий в медицину и биологию позволило разработать диагностическую систему быстрого анализа ДНК патогенного микроорганизма ("наногенная технология"). Этот анализ может быть сделан за несколько минут в любых условиях, причем размеры анализатора не превышают размеров портативного персонального компьютера, а его использование не требует особой подготовки [18].
Таким образом, появление технологических возможностей для создания однонаправленного биологического оружия, использование которого может привести к искусственному сокращению населения планеты, диктует необходимость разработки специальных мер для обеспечения биологической безопасности. При этом следует исходить из того, что главную опасность в ближайшей перспективе будут представлять образцы биологического оружия, базирующиеся на достижениях генной инженерии и расшифровке механизмов функционирования живых систем. В то же время традиционное биологическое (бактериологическое) оружие, скорее всего, будет использоваться террористическими группами и диктаторскими режимами в борьбе за влияние в мире. Поскольку биологическое оружие - продукт так называемых двойных технологий, оно не может быть эффективно ограничено с помощью мер по нераспространению оружия массового поражения.
ЛИТЕРАТУРА
1. Антонов Н. Химическое оружие на рубеже двух столетий. М.: Прогресс, 1994.
2. Carrol S.B., GrenierJ.K., Weatherbee S.D. From DNA to doversity: molecular genetics and the evolution of animal design. Blackwell, 2001.
3. Киселев Л.Л. Геном человека и биология XXI века // Вестник РАН. 2000. № 5.
4. Спирин А.С. Современная биология и биологическая безопасность // Вестник РАН. 1997. № 7.
5. Borrebaeck С.А.К. Antibodies in diagnostics - from im-munoassays to protein chip // Immunology Today. 2000. V. 21. P. 379-382.
6. Dixon T.C., Meselson М., Grullrmin J., Hanna P.C. Antrax // Medical progress. 1999. V. 341. №11.
7. Davies J.C., Geddes D.N., Alton E.W.F.W. Gene therapy for cystic fibrosis // The Journal of Gene Medicine. 2001. V. 3. № 5.
8. Miller S., Simon J., Vesfig J. Interdisciplinary approaches to gene therapy. Berlin-Heidelberg-New York: Springer, 1997.
9. Пальцев M.A. Молекулярная медицина и прогресс фундаментальных наук // Вестник РАН. 2002. № 1.
10. Smith A. E. Gene therapy - where are we // The Lancet. 1999. V. 354. (Suppi. 1). P. 1-4.
11. Dutton G. Debating Gene Therapy's Future // Genetic Engineering News. 2000. V. 20. № 1.
12. Chen W., Calvo P., Malide P., Gibbs J., Shubert U. A novel influenza A virus mitochondrial protein that induces cell death // Nature Medicine. 2001. V. 7. №12.
13. Dutton V. Preparing for Bioweapon Attacks // Genetic Engineering News. 2001. V. 20. № 20.
14. Dutton V. Biotech Counters Bioterrorism // Genetic Engineering News. 2001. V. 21. №.1.
15. Rojanasakul J. Antisense oligonucleatide therapeutics: drug delivery and targeting // Advanced Drug Delivery Reviews. 1996. V. 18. P. 115-131.
16. Murray P., Young R. Stress and immunological recognition in host - pathogen interactions // Journal of Bacteriology. 1992. July. P. 4193-4196.
17. Lowrie D., Silva C., Colston М., Tascon R. Protection against tuberculosis by a plasmid DNA vaccine // Vaccin. 1977. V. 15. №8.
18. Sacks J. Biochip market experiences explosive grows // Genetic Engineering News. 2001. V. 21. № 10.