том 72, № 1,с. 13-21 (2002)
| ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ
НАУК
том 72, № 1,с. 13-21 (2002) |
© М.А. Пальцев
МОЛЕКУЛЯРНАЯ МЕДИЦИНА
И
ПРОГРЕСС ФУНДАМЕНТАЛЬНЫХ НАУКМ. А. Пальцев
Пальцев Михаил Александрович - академик РАН и РАМН,
ректор Московской медицинской академии им. И.М. Сеченова.Важнейшими достижениями медицины последнего времени следует считать появление в арсенале врачей практически безграничных возможностей вмешательства в процессы жизнедеятельности человеческого организма. Разработка средств и методов управления функциями, воздействие на тончайшие обменные и ферментативные процессы, передача наследственной информации сделали реальностью безопасную хирургию и высокоэффективную терапию многих ранее неизлечимых болезней. Это стало следствием успехов развития фундаментальных наук, изучения проблем жизнедеятельности, а также возникновения и формирования научно-теоретической базы медицины. При всем богатстве и разнообразии прежних культурно-исторических эпох научно-теоретический базис медицины позволял лишь истолковывать накапливающийся врачебный опыт. Теперь в связи с новыми теоретическими основами медицины впервые в ее истории сложилась ситуация, когда разработка средств воздействия на организм человека, методов диагностики, лечения и профилактики заболеваний обеспечивается главным образом в ходе фундаментальных исследований.
На примере решения проблем естественной смерти клеток в живом организме, старения и развития полирезистентности микроорганизмов к лекарственным средствам видно, что медицина постепенно становится молекулярной.
МОЛЕКУЛЯРНЫЕ ОСНОВЫ АПОПТОЗА
В живом организме постоянно действуют механизмы поддержания гомеостаза (баланса между количеством появляющихся и гибнущих клеток, между синтезом и утилизацией различных медиаторов, компонентов внеклеточного матрикса и т.д.). Численность популяции клеток связана с двумя противоположно направленными процессами: митотическим размножением и гибелью клеток (апоптозом и некрозом).
При некрозе клетки набухают, их митохондрии и другие органеллы расширяются из-за нарушения работы ионных каналов, разрываются внутриклеточные и плазматические мембраны. В результате активируются лизосомальные ферменты, а внутриклеточное содержимое, попадая во внеклеточную среду, вызывает воспаление.
Отличительной морфологической особенностью апоптоза является коллапс ядра. Хроматин, который в норме представлен открытыми и конденсированными областями (гетеро- и эухроматин), становится суперконденсированным в виде полумесяца по периферии ядра. В этот момент начинается фрагментация ДНК. На ранних стадиях апоптоза, в отличие от некроза, клетка сморщивается, теряя за несколько минут до трети своего объема.
Далее апоптотическая клетка превращается в совокупность окруженных мембраной апоптозных телец, которые фагоцитируются макрофагами и соседними клетками. Воспаление при этом не развивается. Уничтожение клеток путем апоптоза обеспечивает минимальное повреждение тканей по сравнению с другими механизмами смерти.
Апоптоз может быть определен как физиологический процесс освобождения от ненужных организму клеток. Апоптотическая гибель клеток наблюдается при дифференцировке и формировании тканей и органов. Во взрослом организме биологическая роль апоптоза сводится к регулированию численности популяции и к элиминации клеток, вредных для организма - мутантных или пораженных вирусом. Регулирование численности клеток путем апоптоза наиболее распространено в быстропролиферирующих популяциях (гемопоэтические клетки, половые клетки). Таким образом, апоптоз - широко распространенный общебиологический механизм, ответственный за поддержание постоянства численности и выбраковку дефектных клеток.
Апоптоз могут вызывать как внутриклеточные сигналы, так и внешние, опосредующие свое действие через рецепторные системы. К физиологическим активаторам апоптоза относятся ци-токины (интерлейкины, фактор некроза опухоли, интерфероны, колониестимулирующие факторы, пептидные ростовые факторы) и гормоны (глюкокортикоиды, половые гормоны, гормоны гипофиза). Их влияние на клетки неоднозначно: для одних клеток они выступают в роли индуктора, для других - ингибитора апоптоза. Это зависит от типа клетки, стадии ее дифференцировки и функционального состояния.
Гуморальная регуляция апоптоза опосредует-ся специфическими рецепторами. Лучше всего изучена последовательность событий, приводящих клетку к апоптозу в результате взаимодействия белков из семейства фактора некроза опухоли (ФНО) со специфическими рецепторами, представленными системой Fas/Fas-L. Причем для этой системы неизвестны другие функции, кроме индукции апоптоза. Взаимодействие Fas с Fas-L (лиганд) или с моноклональными антителами приводит к апоптозу клетки. Fas экспрессируется на поверхности клеток многих типов: на тимоци-тах, лимфобластах, активированных Т- и В-лим-фоцитах, а также на фибробластах, гепатоцитах, кератиноцитах и миелоидных клетках. При связывании лиганда с рецептором происходит активация апоптоз-специфической протеазы - каспазы-8 и развиваются характерные для апоптоза процессы.
Мутации в гене Fas или в гене Fas-L приводят к развитию аутоиммунных заболеваний. У пациентов, страдающих системной красной волчанкой, ревматоидным артритом и т.п., в сыворотке крови и жидких средах организма часто обнаруживаются растворимые формы Fas, что и обуславливает нарушение процесса апоптоза, достаточное для развития системного аутоиммунного процесса. К заболеваниям, в патогенезе которых важное место принадлежит апоптозу, относят также псориаз и инсулинзависимый сахарный диабет.
Протеазы играют ведущую роль в запуске и развитии процесса апоптоза. При апоптозе, в отличие от физиологического ответа клетки, действуют свои, характерные только для апоптоза, специализированные необратимые реакции про-теолиза, катализируемые специфическими протеазами, относящимися к классу цистиновых протеаз. Эта группа протеаз, названных каспазами (caspases), существует обособленно. С - отражает механизм протеолиза (в активном центре находится цистеин). Asp - обозначает аспарагиновую кислоту, которая распознается как субстрат. Ase -окончание, свойственное ферментам. В настоящее время в различных клетках млекопитающих обнаружено 10 каспаз, образующих ферментативный каскад, подобный ферментативному каскаду свертывающей системы крови или системы комплемента.
Деградация ДНК является терминальной фазой апоптоза. Вначале происходит образование крупных фрагментов, содержащих примерно 300 тыс. пар оснований (п.о.), несколько позже - более мелких, состоящих из 30-50 тыс. п.о. Затем наступает заключительный этап фрагментации ДНК - межнуклеосомная деградация с формированием фрагментов, содержащих 180 п.о. (протяженность нити ДНК в нуклеосоме) или кратных им по величине. Именно эти фрагменты выявляются в виде "лесенки" при электрофорезе ДНК (лизаты апоптотических клеток), который широко используется для идентификации апоптоза. Именно на выявлении фрагментации ДНК основаны морфологические тесты на апоптоз.
До последнего времени считалось, что нерепарируемые повреждения ДНК приводят клетку к гибели из-за невозможности полноценной транскрипции генов, имеющих дефекты в матрице ДНК. Исследования последних лет привели к формированию представления о механизме гибели клеток, имеющих повреждения ДНК, как процессе, осуществляемом в соответствии с определенной генетической программой (рис. 1).
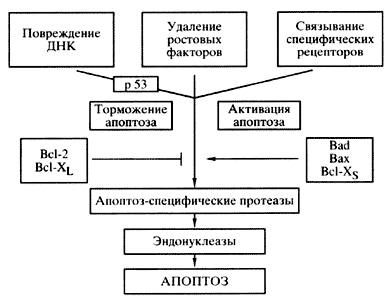
Рис. 1. Этапы апоптоза
В индукции этой программы важная роль принадлежит белку р53. Этот белок локализован в ядре клетки и является одним из факторов, регулирующих транскрипцию генов, причастных к задержке клеток в фазе клеточного цикла G1. При повреждении ДНК происходит активация экспрессии гена р53. Блокирование клеточного цикла в фазах G1 и G2 до репликации ДНК и митоза делает возможной репарацию поврежденной ДНК и предотвращает тем самым появление мутантных клеток. Если активность репарационных систем недостаточна и повреждение ДНК сохраняется, то индуцируется апоптоз как механизм защиты организма от присутствия клеток с поврежденной ДНК, т.е. мутантных и способных к злокачественной трансформации.
Мутации гена р53 позволяют таким клеткам сохранять жизнеспособность, что чревато выживанием клеток, подвергшихся опухолевой трансформации. И действительно, при опухолевой трансформации обнаружено значительное количество мутаций гена р53. Мутации гена р53 связаны с плохим прогнозом при лечении злокачественных новообразований. Такие опухолевые клетки оказываются резистентными к лучевой и химиотерапии. И, наоборот, опухоли с нормальным р53 легко поддаются лечению. Итак, блокирование процесса апоптоза, происходящее на разных стадиях канцерогенеза, приводит к снижению способности трансформированных клеток активировать программу клеточной гибели, что определяет прогрессию опухоли.
Процесс регулируемой клеточной гибели можно разделить на несколько фаз: инициацию апоптоза, проведение сигнала, активацию каспаз, активацию эндонуклеаз и специфическую деградацию ДНК. Если начальные фазы различаются в зависимости от типа клеток и от апоптоз-инду-цирующего сигнала, то этап деградации ДНК универсален для большинства клеток. Эта фаза -переход к необратимой терминальной стадии апоптоза, которую контролируют белки семейства Вс1-2, производные одноименных генов. (Вс1-2 представляет собой белок, локализованный на мембране митохондрий, ядра и эндоплазматичес-кого ретикулума, где его можно обнаружить.)
Выяснение роли белков семейства Вс1-2 занимает центральное место в изучении регуляции процесса апоптоза. Известно, что белки этого семейства относятся либо к индукторам апоптоза (Bad, Вах, Bcl-XS, Bik, Bid, Bak), либо к ингибиторам (Вс1-2, Bcl-XL). Белки семейства Вс1-2 находятся в постоянном динамическом равновесии, образуя гомо- и гетеродимеры, что в конечном счете влияет на развитие апоптоза клеток. Поэтому считается, что соотношение активных форм этих белков определяет реостат жизни и смерти клетки.
РОЛЬ АПОПТОЗА В ПАТОГЕНЕЗЕ ЗАБОЛЕВАНИЙ
Нарушение регуляции апоптоза приводит к возникновению различных заболеваний, связанных с усилением или, наоборот, торможением апоптоза. Сведения о рецептор-опосредованной регуляции апоптоза позволили разработать методы терапии гормон-зависимых новообразований. С помощью андроген-блокирующей терапии лечат рак простаты. Рак молочной железы часто подвергается регрессии при применении антагонистов эстрогеновых рецепторов. Информация о биохимических сигнал-передающих путях регуляции апоптоза позволяет эффективно применять антиоксидантную терапию, а также использовать препараты, регулирующие концентрацию кальция либо активирующие (ингибирующие) различные протеинкиназы.
Осознание роли апоптоза в гибели клеток интенсифицировало поиск средств, защищающих их от апоптоза. Многообещающими являются подходы, связанные с регуляцией апоптоз-специ-фических генов и реализующиеся, в частности, в генной терапии - одной из самых перспективных областей современной медицины. Она используется при лечении заболеваний, вызванных нарушением функционирования отдельных генов.
Проведенный по Medline поиск обнаружил 15660 научных работ, выпущенных с 1995 по 2000 г. и посвященных проблемам генной терапии. К марту 2000 г. количество клинических испытаний в области генной терапии достигло 350. Количество пациентов при этом превысило 2000 человек. 67% из них имели отношение к онкологии, причем в 31% этих случаев использовалась иммунотерапия ex vivo, в 32% - иммунотерапия in vivo, 15% основывались на работе суицидальных генов и только в 2% использовали вектор-активирующий клеточный лизис. Развитие генной терапии идет не всегда равномерно и предсказуемо. Надежды на широкое использование ее при лечении генетически обусловленных заболеваний человека пока не оправдались. По мнению швейцарских специалистов, должно пройти не менее двух десятилетий, прежде чем можно будет говорить о широком внедрении генной терапии в повседневную практику. Греческие авторы считают, что генная терапия еще не может считаться пригодной для эффективного применения в клинике. Их коллеги из США, Германии, Великобритании и Франции полагают: имеющиеся данные доклинических и ряда клинических исследований, а также темпы развития современной техники позволяют с уверенностью утверждать, что ближайшие годы будут отмечены быстрым прогрессом генной терапии и ее применения в трансплантологии, онкологии и лечении иммунодефицитных заболеваний.
Кроме того, в клинических испытаниях и клинической практике широко используется сочетание геннотерапевтических методов с иммунотерапевтическими, химиотерапевтическими и радиационными методами лечения. Денежные расходы на лечение больных с дефицитом аденозиндеаминазы с учетом стоимости стационарного лечения методом генной терапии составили 19 млн. японских иен против 7.4 и 10.5 млн. иен при лечении методом трансплантации.
При создании лекарственных препаратов избирательного действия, которые позволили бы осуществлять направленное регулирование процессов пролиферации и программированной смерти клеток, наиболее перспективными оказались антисмысловые олигонуклеотидные последовательности (антисенсы). Они могут строго избирательно блокировать определенные участки генов, участвующие в пролиферации и апоптозе (рис. 2).
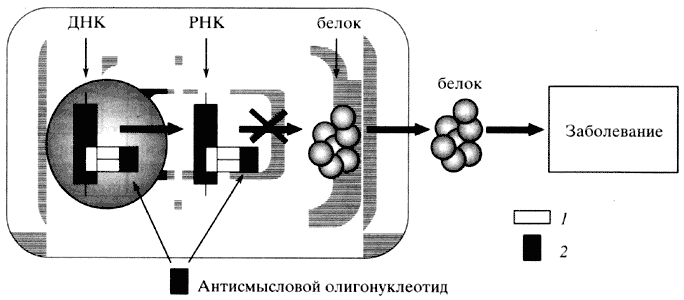
Рис. 2. Механизм действия антисмысловых олигонуклеотидов (антисенсов)
Доставка антисенсов в ядро (блокирование определенных участков ДНК) или в цитоплазму (ингибирование молекул РНК) приводит к избирательному торможению синтеза функционально важного белка. При этом избирательность действия антисенсов достигается высокой ком-плементарностью их связывания с определенным участком гена. Как правило, успех такой терапии определяется правильным выбором векторной белковой молекулы, которая используется для транспорта антисенса через цитоплазматическую мембрану клетки.
Для развития генной терапии большое значение имеет разработка принципиально новых способов доставки генетического материала в целевые клетки-мишени. В настоящее время наиболее эффективно используются наночастицы, различные вирусные системы и белки-переносчики. Наночастицы обладают селективной гидрофобностью и большей стабильностью по сравнению с липосомами и, следовательно, при таком же широком спектре применения, как у последних, наночастицы более технологичны. Кроме того, высокая гидрофобность наночастиц позволяет использовать их для избирательного транспорта через гемато-энцефалический барьер.
Системы доставки генетического материала, основанные на использовании аденовирусов и различных респираторных вирусов, характеризуются большой емкостью и эффективностью, однако в некоторых случаях наблюдается слабовыраженная воспалительная реакция респираторного тракта.
Получили широкое распространение и системы, основанные на явлении рецептор-опосредованного транспорта. При эндоцитозе достигается эффективная доставка лекарственных препаратов внутрь клетки. В качестве белков-переносчиков широко используются ос-фетопротеин, транс-феррин и др.
Наиболее перспективным подходом для избирательной активации апоптоза целевых клеток является создание комплементарных антисмысловых олигонуклеотидных последовательностей к определенным участкам гена Вс1-2, что должно привести к ингибированию синтеза белка Вс1-2 и, следовательно, к избирательной активации апоптоза клеток-мишеней. Антисенс к гену Вс1-2, ковалентно присоединенный к фактору роста для эффективного транспорта через цитоплазматическую мембрану, активирует апоптоз целевых клеток.
ПРОБЛЕМА СТАРЕНИЯ И РЕГУЛЯЦИЯ ТЕЛОМЕРАЗНОЙ АКТИВНОСТИ
Эукариотические хромосомы имеют на своих концах специализированные структуры - теломеры. Теломерная ДНК состоит из многократно повторяющихся G-богатых гексануклеотидов (TTAGGG у позвоночных). Теломеры играют ключевую роль в стабилизации хромосом во время репликации, защищая их концы от экзонуклеаз и лигаз, а также предотвращают деградацию и нежелательную рекомбинацию, например, слияние концевых участков разорванных хромосом (рис. 3).

Рис. 3. Биологическое старение
В 1971 г. А.М. Оловниковым была сформулирована проблема репликации концевых участков линейных молекул ДНК - теломер [1, 2]. ДНК-полимераза может осуществлять синтез только в направлении от 5'-конца ДНК к 3'-концу, присоединяя нуклеотиды к уже имеющемуся участку ДНК или к РНК-праймеру. После репликации РНК-праймеры удаляются, а образовавшиеся короткие "пробелы" заполняются комплементарными нуклеотидами с помощью ДНК-полимеразы. На 5 '-конце такой "пробел" остается незаполненным, в результате чего с каждым актом клеточного деления новая цепь ДНК становится короче. Такое укорочение хромосом тем не менее не приводит к потере генетической информации, поскольку утрачиваются лишь "бессмысленные" теломерные повторы.
Спустя 14 лет идея А.М. Оловникова получила экспериментальное подтверждение. В 1985 г. Гридер и Блэкбэрн обнаружили необычный фермент - теломеразу, компенсирующий укорочение эукариотических хромосом достраиванием утраченных нуклеотидных последовательностей [3].
В середине 90-х годов стало ясно, что большинство иммортальных (бессмертных) клеток, способных бесконечно пролиферировать (к их числу в первую очередь относятся раковые), содержит теломеразу. В злокачественных клетках детектируется довольно высокий уровень теломеразной активности, а сами теломеры в них короткие и стабильные. В то же время для большинства соматических клеток человека характерно отсутствие детектируемого уровня теломеразной активности, а теломерная ДНК, весьма протяженная при рождении (12-15 тыс. п.о.), укорачивается с возрастом. Данное обстоятельство породило настоящий бум вокруг теломеразы и послужило импульсом к последующим многочисленным исследованиям механизмов функционирования и регуляции данного фермента.
Теломераза представляет собой рибонуклеопротеиновый комплекс, для проявления ферментативной активности которого необходимы как РНК, так и белковые компоненты. Примечательно, что теломеразная РНК содержит в своем составе матрицу для синтеза теломерных повторов ДНК. Таким образом, теломераза является своеобразной обратной транскриптазой.
Механизм действия этого фермента можно представить следующим образом. Теломераза связывается с 3'-концом теломеры и последовательно добавляет к нему дезоксирибонуклеотиды, комплементарные РНК-матрице (элонгация), после чего происходит транслокация, т.е. перемещение ДНК, удлиненной на один повтор, относительно фермента. Далее комплементарная цепь достраивается с помощью ДНК-полимеразы. Теломера при этом удлиняется. Необходимо отметить, что теломераза синтезирует лишь небольшой участок теломеры, утрачиваемый вследствие концевой репликации. Основная же часть теломерной ДНК реплицируется путем обычного синтеза ведущей и отстающей цепей с помощью ДНК-полимеразы.
Ген, кодирующий матричную РНК теломеразы человека, клонирован с помощью основанного на ПЦР (полимеразная цепная реакция) метода вычитания. В подавляющем большинстве соматических клеток человека на стадии раннего эмбриогенеза происходит выключение гена (генов), кодирующего теломеразу. Тем самым инициируется процесс прогрессивного укорочения теломер, или так называемого "репликативного" старения. В настоящее время накопилось значительное количество экспериментальных данных, подтверждающих корреляцию между длиной теломер и процессом старения и составляющих в настоящее время довольно стройную так называемую "теломерную теорию старения и иммортализации".
В отличие от нормальных клеточных штаммов линии аномальных бессмертных клеток, в первую очередь раковых, не стареют и содержат активную теломеразу. Обнаружена экспрессия теломераз в некоторых типах нормальных клеток, в частности, в тканях плода, нормальных стволовых клетках костного мозга, семенниках, лимфоцитах периферической крови и эпидермисе кожи. При этом для всех этих клеток характерна либо высокая скорость обновления, либо принадлежность к постоянно размножающемуся пулу дифференцирующихся клеток.
Теломеразная активность обнаружена в общей сложности в 89.4% случаев из более чем 2600 протестированных образцов опухолей человека. Активность данного фермента представляется одним из наиболее приемлемых онкомаркеров человека. Теломеразная активность, по-видимому, необходима для пролиферации раковых клеток [4].
Важным прорывом в исследовании природы опухолевой трансформации признана работа [5]. Американским ученым в результате 15-летних исследований удалось осуществить трансформацию нормальных клеток человека в опухолевые за счет одновременной трансфекции тремя генами: геном Ras, геном большого Т-антигена вируса SV-40 и геном каталитической субъединицы теломеразы (рис. 4). При этом трансфецированные клетки человека, не содержащие гена теломеразы или активной теломеразы, не приобретали свойств опухолевых клеток. Поиск ингибиторов теломеразы идет по двум основным направлениям: создание антисмысловых олигонуклеотидов к теломеразной РНК и изучение действия на теломеразу известных ингибиторов обратных транскриптаз.

Рис. 4. Трансформация нормальных клеток человека в опухолевые
1 - ген каталитической субъединицы теломеразы (hTERT);
2 - ген Ras онкогена;
3 - ген большого Т-антигена SV-40МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ ПОДХОДЫ В ЛЕЧЕНИИ ТУБЕРКУЛЕЗА
Туберкулез - болезнь, убивающая 3 млн. человек ежегодно и являющаяся одной из самых актуальных проблем здравоохранения. Особую значимость проблема туберкулеза приобрела в последнее время в силу определенно установленного факта частой ассоциации туберкулеза с ВИЧ-инфекцией. Сведения об иммунной системе, межклеточных взаимодействиях, накопленные за последние десятилетия, позволяют по-новому подойти к патогенезу туберкулеза. Формирование полирезистентных штаммов микобактерий туберкулеза, как один из итогов полувековой истории противотуберкулезной терапии, и заметное увеличение числа больных иммунодефицитами создают новые проблемы.
Туберкулез чаще всего развивается в результате заражения микобактериями человеческого вида, выделяемыми больным человеком. Наиболее частый путь заражения - аэрогенный, но возможен и алиментарный. Определенную защитную роль при аэрогенном заражении играет система мукоцилиарного клиренса, позволяющая вывести попавшие в бронхи частицы пыли, капельки слизи, слюны, мокроты, содержащие микроорганизмы. При энтеральном заражении имеет значение всасывающая функция кишечника.
После проникновения микобактерий в организм человека, не болевшего ранее туберкулезом, в качестве первой защитной реакции развивается фагоцитоз. Эффективность этой защитной реакции зависит от многих факторов: возраста, пола, различных индивидуальных факторов риска, наследственной резистентности или предрасположенности к туберкулезу. Течение туберкулезной инфекции определяется состоянием иммунитета, как врожденного, так и приобретенного.
Процесс взаимодействия легочных макрофагов с микобактериями туберкулеза очень сложен и до конца не изучен. Результат этого взаимодействия связан с рядом механизмов, в том числе определяющих переваривающую способность макрофагов. При недостаточной переваривающей способности макрофагов микобактерий туберкулеза могут сохраняться в них и даже размножаться, приводя к разрушению макрофагов.
Развитие остропрогрессирующих форм туберкулеза связывают с быстрым размножением микобактерий и образованием огромной бактериальной популяции, уничтожение или уменьшение которой с помощью противотуберкулезных препаратов невозможно из-за имеющейся к ним полирезистентности.
При лечении антибиотиками постепенно возникают популяции бактерий, которые обладают высокой устойчивостью к действию различных антибиотиков. Некоторые штаммы таких бактерий, как, например, Mycobacterium tuberculosis и Pseudomonas aeruginosa, обладают множественной устойчивостью к известным антибиотикам и, по существу, вызывают неизлечимые инфекционные заболевания. При начальном этапе взаимодействия бактерий с новым антибиотиком большинство бактерий погибает, поскольку они исключительно чувствительны к новому лекарственному препарату, однако некоторые бактерии могут выжить, особенно если количество антибиотика было недостаточным, чтобы убить все бактериальные клетки. При продолжающемся лечении антибиотиками могут появляться бактерии с повышенной устойчивостью за счет генетических мутаций или обмена генами с бактериями, уже обладающими высокой устойчивостью к действию антибиотиков. Так возникают бактерии с множественной устойчивостью к наиболее известным и широко используемым в медицинской практике антибиотикам.
Бактерии могут захватывать "гены устойчивости" к антибиотикам различными путями (рис. 5). Часто бактерии захватывают целую плазмиду, несущую гены устойчивости из донорской клетки. В других случаях гены устойчивости могут быть занесены вирусами или бактерии сами захватывают фрагменты ДНК, несущие гены устойчивости из умерших бактериальных клеток, находящихся в непосредственной близости. Антибиотикоустойчивые бактерии могут проявлять множественную устойчивость к действию антибиотиков различными путями. Например, гены могут кодировать белки мембранных насосов, которые легко выбрасывают из клетки поступившие лекарственные препараты, а также ферменты, которые расщепляют или модифицируют с последующей инактивацией молекулы антибиотиков. Наиболее известный пример - это синтез фермента пенициллиназы, который расщепляет пенициллин. Гены устойчивости могут локализоваться на бактериальных хромосомах или в небольших кольцевых плазмидах.

Рис. 5. Гены устойчивости
Гены, устойчивости к действию антибиотиков, кодирующие
1 - мембранные насосы, выбрасывающие антибиотики;
2 - ферменты, расщепляющие антибиотики;
3 - ферменты, модифицирующие антибиотикиВ 1998 г. группой ученых из Великобритании, Франции, США и Дании была завершена расшифровка генома М. tuberculosis [6]. Оказалось, что микроорганизм обладает рядом уникальных особенностей. Обнаружено достаточное количество генов, позволяющих производить белковые продукты, ответственные за проникновение микроба внутрь клеток хозяина и поддержание в них устойчивого существования.
Одной из примечательных черт генома М. tuberculosis является присутствие генов, многократно дублирующих функционирование ключевых ферментативных систем. Примерами могут служить 36 вариантов ацил-СоА синтазы и ацил-СоА дегидрогеназы. Геном М. tuberculosis состоит из 4.4 млн. пар оснований, или более 4 тыс. индивидуальных генов.
Проблема преодоления множественной устойчивости бактерий к лекарственным препаратам является важнейшей проблемой медицины XXI в. Актуальность проблемы лекарственной устойчивости М. tuberculosis особенно очевидна, поскольку туберкулез в настоящее время становится бедствием глобального масштаба.
Отсутствие восприимчивости к антибиотикам сочетается с генетически обусловленным изменением метаболизма бактерий, в результате которого биохимическая реакция, являющаяся мишенью конкретного химического агента, перестает быть важной для жизнедеятельности бактерии. Изменения метаболизма возникают в результате искусственной антибиотик-индуцированной селекции тех генетических вариантов М. tuberculosis, в которых ключевой обменный процесс с участием конкретного белкового продукта не активирован в силу устойчивой мутации в определенном гене. Иллюстрацией могут служить данные по исследованию причин лекарственной устойчивости к изониазиду, левомицетину и рифампицину.
Применение новых антибиотиков (амикацин и фторхинолоны) способно лишь отчасти улучшить ситуацию и, в конечном счете, приведет к началу нового цикла антибиотик-индуцированной селекции высокоустойчивых штаммов.
Устойчивость М. tuberculosis к антимикробным препаратам принято подразделять на первичную и вторичную (приобретенную). Под первичной лекарственной устойчивостью (ЛУ) подразумевают наличие резистентных штаммов М. tuberculosis у больного туберкулезом, который никогда не подвергался химиотерапии. Первичная ЛУ может быть обусловлена заражением людей от больных туберкулезом, выделяющих ЛУ-штаммы М. tuberculosis. При этом у вновь выявленных больных, не подвергавшихся противотуберкулезной терапии, устойчивость выделенных штаммов М. tuberculosis к лекарственным препаратам определяют как начальную. Вторичная, или приобретенная, ЛУ является следствием развития у М. tuberculosis устойчивости к противотуберкулезным препаратам в процессе лечения.
Чаще всего наблюдается устойчивость к изониазиду, стрептомицину, реже к этамбутолу и рифампицину. Обращает на себя внимание значительное преобладание у обследованных больных штаммов с вторичной ЛУ (в среднем в 2-5 раз). При этом доля множественно лекарственно устойчивых (МЛУ) штаммов с первичной устойчивостью составляет 4.3-12% среди всех выделенных культур, а среди вторично устойчивых вариантов эта доля может доходить до 50%.
Основной причиной появления ЛУ-штаммов М. tuberculosis считают неадекватную химиотерапию больных туберкулезом: неправильный выбор лекарственных препаратов, несоблюдение режима их применения, недисциплинированность пациентов и т.п. Факторы, способствующие развитию лекарственной устойчивости М. tuberculosis, одинаковы во всем мире. Эпидемиологический анализ распространения МЛУ-штаммов М. tuberculosis показал, что эта неадекватная химиотерапия обусловлена слабой инфраструктурой программ по борьбе с туберкулезом. В них лечение больных не рассматривается как приоритетное направление, и врачи используют нестандартные режимы и схемы терапии, не соответствующие установленным нормам. Кроме того, используемые программы не обеспечивают контроль за ходом лечения пациентов.
Диссеминации ЛУ-штаммов М. tuberculosis во многом способствует ввоз инфекции в страны с низким уровнем заболеваемости туберкулезом из регионов с высоким уровнем заболеваемости, а также передача инфекции воздушно-капельным путем в крупных городах. Особого внимания требует практически не контролируемое распространение туберкулеза, вызванного МЛУ-штаммами М. tuberculosis, среди ВИЧ-инфицированных пациентов.
Таким образом, развитие лекарственной устойчивости М. tuberculosis на фоне роста заболеваемости отражает весь драматизм сложившейся в настоящее время эпидемической ситуации по туберкулезу. По сути дела, феномен лекарственной устойчивости можно рассматривать как качественный показатель неэффективности мероприятий по борьбе с туберкулезом, проводимых в большинстве стран.
Перспективные направления в лечении заболевания основываются на знании патогенеза. Одной из его ключевых стадий является персис-тенция возбудителя в макрофагах, которые фагоцитируют микроб в очагах воспаления, но теряют способность элиминировать его в лизосомах. В результате возбудитель сохраняется в эндосомах, что, в конце концов, приводит к его массированному размножению и гибели клеток. С точки зрения развития новых подходов к терапии туберкулеза очевидна необходимость контроля прохождения микроорганизма по эндосомально-лизосомальному пути: от ранней эндосомы - к поздней, от поздней эндосомы - к лизосоме. Доказано влияние на созревание эндосом самых различных агентов.
Исследования генома бактерии показывают зависимость ее жизнеспособности от содержания двухвалентных ионов, преимущественно Fe2+. В стенках эндосом макрофагов человека обнаружен белок Nramp, одной из функций которого является транспорт ионов железа в цитоплазму (рис. 6). Испытывающие дефицит железа микроорганизмы не способны к внутриклеточной персистенции и быстро погибают. У лиц, восприимчивых к заражению туберкулезом, часто встречается мутация по гену этого белка. Восстановление исходного немутированного генотипа антиген-представляющих клеток человека приводит к нормализации продукции белка, увеличению транспорта ионов железа из эндосом, угнетению роста М. tuberculosis в них, и, следовательно, способно существенно улучшить сопротивляемость организма человека инфекции.

Рис. 6. Контроль внутриклеточной персистенции М. tuberculosis
Для решения этой проблемы могут быть использованы разработанные в настоящее время методы генной терапии. Доставка нормальной версии гена Nramp в клетки-мишени может быть осуществлена как вирусными, так и невирусными векторами. При этом должны быть использованы новейшие методы генной терапии с целью избирательного блокирования М. tuberculosis в условиях его комфортного существования в макрофаге.
Становится очевидным, что необходимо разрабатывать принципиально новые подходы к лечению заболевания. Наиболее приемлемым подходом к решению проблемы представляется избирательное воздействие на целевые клетки человеческого организма, являющиеся комфортным убежищем для этого опасного и хорошо выраженного врага человеческого организма.
Продолжающаяся фундаментализация медицины привела к пониманию того, что прогресс клинической медицины полностью зависит от медицины молекулярной, т.е. исследований, проводимых на уровне генов и молекул. Пренебрежение или невнимание к этой проблеме могут существенно повлиять на темпы развития фундаментальных основ медицины и в значительной мере ограничить влияние достижений теоретической мысли на практику.
ЛИТЕРАТУРА
1. Оловников А.М. Принципы маргинотомии в матричном синтезе полинуклеотидов // Доклады АН СССР. 1971. С. 1496-1499.
2. Olovnikov А.М. A theory of marginotomy: the incomplete copying of template margin in enzymatic synthesis of polynucleotides and biological significance of the phenomenon // Theor. Biol. 1973. P. 181-190.
3. Greider C.W., Blackburn E.H. Identification of specific telomere terminal transferase activity in Tetrahymena extracts // Cell. 1985. № 43. P. 405-413.
4. Meeker A.K., Coffey D.S. Telomerase: a promising marker of biological immortality of germ, stem, and cancer cells // A review. Biochemistry (Moscow). 1997. № 11. P. 1547-1557.
5. Hahn W.C., Counter CM., Lumdberg A.S., Beijershergen R.L., Brooks M.W., Weinberg R.A. Creation of human tumour cells with defined genetic elements // Nature. 1999. № 400. P. 464-468.
6. Cole S.T. et al. Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence // Nature. 1998. P. 537-544.