№12, 2004 г.
© Баранов В.С., Баранова Е.В.
Жить в гармонии
со своими генамиВ.С. Баранов, Е.В. Баранова
Владислав Сергеевич Баранов, чл.-корр. РАМН, проф., гл. спец. города по медицинской генетике,
зав. лаб. пренатальной диагностики наследственных и врожденных болезней
Института акушерства и гинекологии им.Д.О.Отта РАМН.
Елена Владиславовна Баранова, президент Международной aссоциации по предиктивной медицине.Вряд ли в наш просвещенный век компьютеров, Интернета, космических полетов и всеобщей глобализации найдется человек, который не слышал о полной расшифровке генома человека. Об этом мировая общественность была торжественно оповещена 22 апреля 2003 г., как раз в 50-летний юбилей знаменитой двойной спирали ДНК. Сам грандиозный международный проект, который представляла собой эта программа, и те события, та гонка, которую предложила Международному консорциуму преуспевающая частная фирма “Celera Genomics”, заслуживают отдельного рассмотрения, далеко выходящего за рамки нашей темы.
Да, книга нашей наследственности прочитана почти полностью (98%) и почти точно (вероятность ошибки 10–6). Что же такое “геном”? Что уже дало человечеству знакомство с энциклопедией собственной наследственности? И самое главное — что сулит человеку это запрограммированное и выстраданное тысячами ученых открытие? Обещает ли оно рай, т.е. избавление от болезней, долгую здоровую жизнь или, как в случае печально известной овечки Долли, оно только усугубит многие уже существующие противоречия и проблемы нашей жизни? Рано или поздно любое большое открытие выходит за пределы академической науки. Становясь вполне самостоятельным, оно начинает активно вмешиваться в жизнь общества. Не станут ли уже в ближайшем будущем горячие головы, такие как те, кто сегодня грозится клонировать человека, на свой страх и риск торговать генами, манипулировать геномами и улучшать человеческую породу?
Попробуем разобраться в этом клубке противоречий, загадок и недомолвок, порожденных достижениями современной генетики. Вспомним, что каждое выдающееся открытие, каждый прорыв науки в бесконечность непознанного имеет две стороны. С одной стороны, оно приносит благо, с другой — таит скрытую опасность. Воистину, наши знания множат нашу скорбь! Атомная энергия, электричество, космонавтика тому яркие примеры. Нечто подобное происходит сегодня с геномом человека.
Итак, геном — это весь наследственный аппарат любого организма, в том числе и человека. Говоря биохимическим языком — это его ДНК, в форме непрерывной двойной спирали. Расфасованная в 46 хромосом, она присутствует в каждой клетке человека. Общая длина этой гигантской молекулы поражает — 1.7 м! Состоит она всего из четырех букв (нуклеотидов), число которых, как сейчас точно известно, составляет 3.1647·109. По объему такой текст соответствует примерно 200 томам знаменитой Британской энциклопедии! Суть программы “Геном человека” как раз и сводилась к прочтению этого текста, к расшифровке всей нуклеотидной последовательности ДНК человека. На это понадобилось в общей сложности более 10 лет! Зато теперь мы знаем, что у человека имеется около 31 тыс. генов. Примерно половина их (более 15 тыс.) уже картирована на хромосомах, 2 тыс. идентифицированы (т.е. выяснена их точная молекулярная структура), а некоторые выделены в чистом виде. И это только первые шаги постгеномной эры! Геном декодирован, но он еще не прочитан! Многое в его первичной структуре остается загадочным и малопонятным. Например, только 3—5% всей гигантской цепочки ДНК выполняет кодирующие функции. А для чего нужна вся остальная молекула!?
Другая трудная проблема: генов много, а что они делают в организме, а точнее, каковы функции их продуктов, неизвестно. Отсюда логичное продолжение программы: развитие функциональной геномики — науки о взаимодействии генов и их продуктов в процессах индивидуального развития (онтогенеза) в норме и в патологии. Если генетика изучает отдельные гены и признаки, то пришедшая ей на смену геномика исследует структурно-функциональную организацию целого генома, т.е. весь наследственный аппарат клетки, ее ДНК.
Параллельно с геномом человека активно изучались геномы и других организмов, в том числе вирусов, бактерий, дрожжей, насекомых (дрозофил), червей, растений, рыб и млекопитающих (лабораторной мыши). Отсюда еще одно интересное направления постгеномной эры — сравнительная геномика и ее ответвления — палеогеномика и этногеномика. Первая изучает происхождение человека, а вторая — процессы этногенеза, т.е. происхождение наций и рас, их расселение по планете. Наконец, расшифровка генома человека привела к возникновению такого магистрального направления современной науки, как молекулярной медицины. В ее основе лежат представления о геноме человека, который отличается индивидуальностью (каждый человек имеет свой собственный, уникальный геном), и профилактическая направленность (особенности генома каждого можно выяснить задолго до заболевания). Ниже мы вернемся к молекулярной медицине и рассмотрим ее более детально. Здесь же обратим внимание читателей на то новое, что уже привнесли исследования генома в современную медицину [1]:
— идентифицированы мутантные гены всех частых наследственных и многих ненаследственных (мультифакториальных) заболеваний, в возникновении которых повинны как неблагоприятные варианты генов (аллели), так и провоцирующие (повреждающие) факторы внешней среды;Вот мы и подошли к самому главному — предиктивной медицине и ее практическому приложению — тестированию генов предрасположенности.— разработаны универсальные методы диагностики наследственных болезней;
— внедрены и получили широкое применение в криминалистике методы точной идентификации личности (методы геномной дактилоскопии);
— заложены основы и начаты широкомасштабные исследования по фармакогенетике (индивидуальной чувствительности к лекарствам) и фармакогеномике (разработке новых лекарств на основе функциональной геномики);
— разработаны научные основы и начаты клинические испытания по генной терапии наследственных и ненаследственных (онкологических, некоторых инфекционных) заболеваний;
— внедрены и продолжают активно разрабатываться методы тестирования наследственной предрасположенности, заложившие фундамент предиктивной (предсказательной) медицины.
Что же такое предиктивная медицина? Это одно из направлений современной молекулярной медицины, которая изучает возможность прогнозирования (предвидения) заболевания у человека на основе исследования индивидуальных особенностей его генома [2]. Возникла она существенно раньше, чем был расшифрован геном человека, еще в 1977 г. Термин “предиктивная медицина” предложил французский ученый лауреат Нобелевской премии Дж.Доссэ, внесший решающий вклад в открытие и изучение знаменитого локуса HLA — главного локуса антигенной гистосовместимости человека. По его меткому высказыванию: “На протяжении столетий медицина пыталась лечить болезни. Сейчас ее главная цель — предотвратить заболевания. Для этого необходимо научиться предсказывать их вероятность. Первый шаг в этом направлении уже сделан — предиктивная медицина родилась”. При этом ученый имел в виду удивительные и до сих пор малопонятные ассоциации определенных вариантов (аллелей) генетического локуса HLA с некоторыми заболеваниями (сахарным диабетом, бронхиальной астмой и др.).
Сегодня, когда расшифрован весь геном, возможности исследовать генные ассоциации различных заболеваний сильно возросли. Важно отметить, что для каждого заболевания следует тестировать не все известные гены, а только те, которые контролируют продукты (белки, ферменты), непосредственно вовлеченные в тот или иной патологический процесс. Число таких генов даже в случае мультифакториальных заболеваний, к которым относятся все наиболее распространенные болезни (сердечно-сосудистые, онкологические, психические и др.), весьма ограничено. Наиболее обширная группа генов, так называемая генная сеть, определена для сердечно-сосудистых заболеваний — около 200 генов. Генные сети других болезней менее многочисленны и содержат около 40—50 генов.
Участие разных генов в развитии любой патологии далеко не одинаково. Практически для каждой болезни можно выделить главные гены, продукты которых играют ключевую роль в инициации патологического процесса, и второстепенные, чьи продукты играют дополнительную роль. При этом, гены, критичные для одного заболевания, для другого могут оказаться менее важными.
Чем же объяснить, что продукты генов могут влиять и даже в определенных условиях провоцировать болезнь? Дело в том, что, как выяснилось в процессе расшифровки структуры генома, молекула ДНК каждого человека уникальна. В ней имеется множество различных вариантов нуклеотидных последовательностей, характерных именно для данного индивидуума. Они особенно многочисленны на уровне случайных замен единичных букв, нуклеотидов. В общей сложности таких замен (полиморфизмов) на весь геном насчитывается примерно 4 млн. Около 2.5 млн полиморфизмов приходится на смысловую, кодирующую часть генома. Нередко эти замены приводят к изменениям в структуре продуктов соответствующих генов; соответственно меняются и их функциональные свойства. Спектры генетических полиморфизмов зависят от географических условий, диеты, расовой (этнической) принадлежности и др. и возникают в результате естественного отбора. В определенных условиях они могут предрасполагать к развитию специфических заболеваний или, напротив, препятствовать им.
Наличие у человека неблагоприятных вариантов генов, приводящих к появлению функционально ослабленных генопродуктов (белков, ферментов), в конечном счете и лежит в основе наследственной предрасположенности человека к тому или иному недугу. Каждый человек генетически неповторим и, соответственно, для каждого из нас характерен свой уникальный биохимический портрет, который и предопределяет врожденную (наследственную) предрасположенность к тем или иным заболеваниям. Увы, как это ни пессимистично звучит, болезни выбирают нас еще до рождения!
Таким образом, гены предрасположенности — это варианты генов (аллели), совместимые с нормальным ходом онтогенеза, но на более поздних стадиях развития в неблагоприятных условиях они приводят к различным заболеваниям [3].
Изучение полиморфизмов генов предрасположенности и составляет основу предиктивной медицины. Тестируя полиморфизмы генов, выясняя сильные или слабые звенья своего генома, мы можем узнать, какая патология и с какой вероятностью ожидает нас в будущем. Чем детальней мы анализируем собственный геном, тем больше шансов найти в нем функционально ослабленные, мутантные гены, способные спровоцировать то или иное заболевание. Автор знаменитой двойной спирали ДНК лауреат Нобелевской премии Дж.Уотсон так образно выразил эту мысль: “Было принято считать, что наша судьба скрыта в наших звездах. Однако теперь мы точно знаем, что она записана в наших генах”. Тестируя их, мы можем заглянуть в нашу судьбу, оценить слабые и сильные стороны своего генома и, соответственно, своего здоровья.
Однако пока генетическое тестирование позволяет только выявить имеющиеся в геноме тенденции к появлению патологии, повышенную чувствительность человека к тем или иным заболеваниям, но оно не ставит окончательный диагноз. Тем не менее на основе этой информации и современного врачебного опыта можно наметить пути ранней профилактики и с помощью коррекции ослабить неблагоприятные эффекты функционально неполноценных генов. Мы не можем исправлять наши гены, но мы уже в силах влиять на их фенотипические проявления. Генетическое тестирование должно помочь человеку жить в гармонии со своими генами!
Недавно в зарубежной медицинской науке появилось направление “персонофицированная профилактика”, представляющее собой, по сути, ту же предиктивную медицину. Основной упор, однако, в ней делается не на диагностику предрасположенности человека к тому или иному конкретному мультифакториальному заболеванию (для этого, как правило, еще недостаточно данных), а на выявление функционально неполноценных аллелей генов предрасположенности. По данным английских ученых, ослабление их неблагоприятного эффекта с помощью диеты, образа жизни, лекарственных и пищевых добавок позволяет человеку “выиграть” 14 лет активной полноценной жизни!
В настоящее время такое тестирование широко проводится во многих лабораториях и научных центрах мира. За рубежом организуются и уже активно работают многочисленные крупные коммерческие центры и фирмы типа “Myriad Genetics” (США), “Genosense Diagnostic” (Австрия), “Sciona” (Великобритания), “Gendia” (Бельгия). Однако стоимость такого анализа еще достаточно велика: определение состояния одного генного варианта от 150 до 300 евро. У нас стоимость такой процедуры всего 200—300 руб. В России тестирование генов предрасположенности начато в начале 90-х годов безвременно ушедшим из жизни профессором Е.И.Шварцем. В нашей лаборатории оно проводится с 1994 г. В настоящее время это направление уже достаточно широко представлено в Санкт-Петербурге, Москве, Уфе, Томске и в Новосибирске.
Как показали многочисленные исследования, к генам предрасположенности наиболее часто относятся гены, контролирующие ферменты системы детоксикации, гены белков клеточных рецепторов и гены, играющие ключевую роль в различных жизненно важных метаболических циклах организма (так называемые гены метаболических “шунтов”).
В плане тестирования наследственной предрасположенности особенно большой опыт накоплен в отношении генов системы детоксикации (так называемых генов метаболизма), отвечающих за деградацию и выведение из организма всех инородных веществ (ксенобиотиков), включая лекарственные препараты, промышленные и другие вредности. Именно эти гены, точнее их полиморфные варианты, определяют индивидуальную реакцию организма на различные химические препараты и пищевые продукты. Генетические полиморфизмы, которые приводят к полному отсутствию соответствующего белка либо к появлению ферментов с измененной, как правило, более низкой, чем в норме, активностью, служат причиной выраженной индивидуальной чувствительности организма к лекарственным препаратам, промышленным и сельскохозяйственным ядам и пр.
Многочисленные эпидемиологические исследования указывают на то, что практически все широко распространенные болезни, включая почти 90% всех раков, в той или иной мере связаны с неблагоприятными внешними факторами, среди которых видное место принадлежит курению и продуктам питания. Различные химические токсины, воздействуя на организм, также могут провоцировать начало этих заболеваний. Гены метаболизма кодируют белки, по-разному нейтрализующие канцерогены. Поэтому в зависимости от особенностей генома различные индивидуумы или сохраняют устойчивость или, наоборот, обнаруживают повышенную чувствительность к повреждающим агентам. Функционально неполноценные варианты генов метаболизма обнаруживают четкую ассоциацию с бронхиальной астмой (рис.1), раком легких и мочевого пузыря, различными акушерскими и гинекологическими заболеваниями (эндометриозом, привычным невынашиванием, преэклампсией). В нашей лаборатории показано, что анализ таких генов еще до проявления симптомов заболевания позволяет выявить в семьях высокого риска лиц с наследственной предрасположенностью к данной патологии и начать своевременную профилактику. Например, в случае эндометриоза результаты генетического тестирования могут помочь в прогнозе течения болезни и выработке тактики лечения [4].
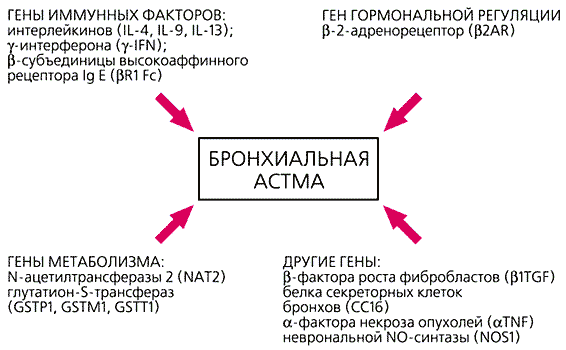
Рис.1. Сложная генная сеть атопической бронхиальной астмы, включающая гены метаболизма,
частоты полиморфизмов которых изучены в нашей лаборатории.Примером рецепторного гена может быть рецептор мужских половых гормонов — адрено-рецептор, ассоциированный с раком предстательной железы, или ген рецептора витамина D, обнаруживший четкую ассоциацию с таким частым заболеванием, как остеопороз (быстрая потеря минеральной плотности кости). Молекулярно-генетическое исследование этого заболевания, проведенное в нашей лаборатории, позволило разработать и внедрить в практику схему обследования для раннего обнаружения лиц с наследственной предрасположенностью. Сравнивая частоту полиморфных аллелей и соответствующих им генотипов по генам остеопороза у больных в популяции северо-западной части России, мы показали достоверную ассоциацию функциональной неполноценности двух генов (гена рецептора витамина D и гена коллагена) с развитием болезни. Изученные нами гены непосредственно вовлечены в процессы остеогенеза, хотя механизмы их действия различны (рис.2). Рецептор витамина D влияет на гормональную регуляцию остеогенеза, а сам коллаген — важная составная часть костной ткани. Согласно нашим данным, анализ аллелей этих двух генов способствует выявлению предрасположенности к остеопорозу и соответственно делает возможной раннюю профилактику [5].
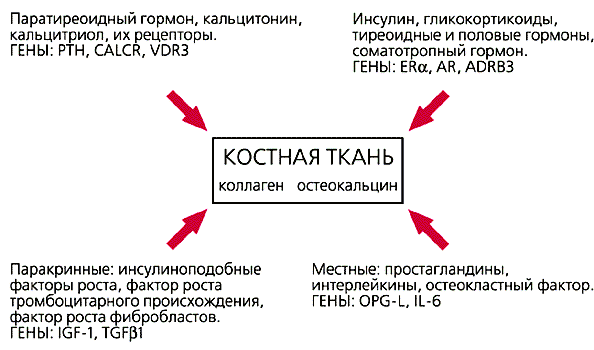
Рис.2. Гены и их белковые продукты, участвующие в метаболизме костной ткани.
Типичным примером гена предрасположенности третьей группы (генов-“шунтов”) может служить ген фермента, отвечающего за превращение в организме фолиевой кислоты, крайне важной для метаболизма ряда аминокислот и ДНК. Функционально неполноценные варианты этого гена ассоциированы с сердечно-сосудистыми заболеваниями, нарушениями развития мозга у плода и даже с болезнью Дауна, вызванной наличием лишней маленькой хромосомы.
Список болезней с наследственной предрасположенностью, для которых уже реально генетическое тестирование в России, включает более 25 наименований, в том числе ишемическую болезнь сердца, сахарный диабет, гипертонию, рак молочной железы, легкого и предстательной железы, болезнь Альцгеймера, наркоманию, бронхиальную астму, остеопороз, парадонтоз и некоторые другие.
Многолетние исследования в нашей лаборатории по изучению генетических полиморфизмов позволили сформулировать представление о генетическом паспорте как об индивидуальной базе ДНК-данных, отражающей уникальные генетические особенности каждого человека, его предрасположенность к тем или иным наследственным, мультифакториальным и другим заболеваниям [6—8]. Один из вариантов такого генетического паспорта разработан нами специально для молодых супругов, планирующих ребенка (рис.3). Согласно этой карте, оба супруга после генетического консультирования должны сделать анализ своих кариотипов (наборов хромосом), пройти тестирование на носительство мутаций наиболее частых генных болезней, таких как муковисцидоз, фенилкетонурия, гемофилия, миодистрофия Дюшенна, некоторые другие. Наконец, женщине предлагается также анализ состояния генов предрасположенности, ассоциированных с частыми осложнениями при беременности. Естественно, что медицинская значимость такой карты во многом определяется квалификацией специалиста, оценивающего результаты предиктивного тестирования.
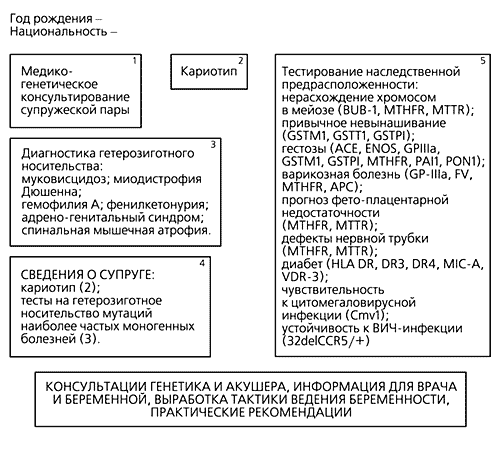
Рис.3. Вариант генетической карты репродуктивного здоровья.
К сожалению, именно эта сторона предиктивной медицины до сих пор остается наименее разработанной. В значительной мере это определяется тем, что предиктивное тестирование носит чисто вероятностный характер. Сегодня оно не дает однозначных прогнозов. Наличие одного или нескольких функционально неполноценных аллелей еще не доказывает, что человек обязательно заболеет именно той болезнью, гены которой тестируются. К сожалению, в мировой медицине пока явно недостаточно информации, позволяющей делать подобные заключения.
Для решения этой сложной проблемы начаты широкомасштабные популяционные исследования по тестированию всех возможных генов предрасположенности у населения Исландии (300 тыс. человек) и Эстонии. В банк данных будут занесены и результаты генетического тестирования 500 тыс. британцев. При этом планируется, что каждый из них будет находиться под медицинским наблюдением практически до самой смерти. Только после этого результаты проведенного генетического тестирования будут раскрыты и сопоставлены с данными конкретной медицинской карты.
Согласно обобщенному мировому опыту предиктивной медицины, сначала рекомендуется проводить массовые исследования по сравнению частот функционально неблагоприятных вариантов (аллелей) в целой популяции и у больных с той или иной патологией. Когда будет установлена четкая ассоциация неблагоприятного аллеля с заболеванием, на втором этапе проводят предиктивное генетическое тестирование в семьях высокого риска, где уже есть подобные больные. Наконец, на третьем этапе, при наличии убедительных данных о четкой ассоциации ген—болезнь, можно выявлять индивидуальную предрасположенность к данному заболеванию. К сожалению, подавляющее большинство уже предлагаемых генетических тестов все еще находится на первом уровне. Их сравнительно немного на втором и практически нет на третьем уровне. Считается, что потребуется еще не менее 10—15 лет, прежде чем генетическое тестирование наследственной предрасположенности достигнет третьего уровня и найдет широкое практическое применение.
Таким образом, строго говоря, предиктивная медицина все еще находится в начале своего длинного, хотя и столь заманчивого пути. Означает ли это, что нужно просто ждать еще 10 лет, пока будет накоплен необходимый опыт? Конечно, нет. Исследования по предиктивому генетическому тестированию должны продолжаться для уточнения генных сетей мультифакториальных и полигенных заболеваний, поиска главных генов, функционально неполноценные варианты которых запускают патологический процесс.
Сейчас, когда стало ясно, что каждый из нас “заложник” собственного генома, в самый раз подумать о том, как заставить его работать на наше здоровье. До расшифровки генома мы ничего не знали об его индивидуальных особенностях и в игру под названием “жизнь” играли вслепую. Генетическое тестирование позволяет заглянуть нам в наши наследственные задатки и сделать эту игру более осмысленной. Один из реальных подходов, позволяющих человеку уже сегодня начать жить в гармонии со своими генами, — упоминавшаяся “персонифицированная профилактика”, направленная на коррекцию функционально неполноценных аллелей генов предрасположенности.
К сожалению, на этом пути имеются серьезные трудности не только медицинского, но и социального плана. Возникает много морально-этических и юридических вопросов. Когда, в каком возрасте следует проводить генетическое тестирование? Кто может иметь доступ к его результатам? Могут, должны ли знать о результатах тестирования близкие родственники? Как и где будут храниться результаты? Все эти сложные вопросы активно обсуждаются и дискутируются на самых разных уровнях. Для выработки наиболее взвешенных решений созданы специальные комиссии, включающие ведущих генетиков. В частности, согласно рекомендациям комиссии Европейского общества по генетике человека (2000, 2003) генетическое тестирование должно быть сугубо добровольным, проводиться только при наличии информированного согласия и быть строго конфиденциальным. К результатам тестирования с согласия пациента может иметь доступ только семейный врач или специалист по интерпретации полученных результатов. Они никак не могут и не должны стать достоянием страховых компаний или работодателей.
Вместе с тем, учитывая нарастающий интерес к индивидуальной генетической предрасположенности и, по сути, неотвратимость массового тестирования, многие ученые высказывают вполне обоснованные опасения о неподготовленности общества в целом, его правовых и юридических служб к решению возникающих проблем. Лауреат Нобелевской премии сэр Поль Нёрс обеспокоен тем, что с наступлением эры персонифицированной медицины и превентивного лечения, когда ребенок уже при рождении будет получать генетический паспорт, вполне реальным может стать и “генетический апартеид”, т.е. дискриминация человека по его генетическим признакам. Чтобы предотвратить это генетическое неравенство, законодательство должно идти в ногу с передовыми технологиями. Только в этом случае можно создать общество, где все будут равны в правах, независимо от состояния генома, где будут устранены все возможности генетической дискриминации.
Итак, эра торжества предиктивной медицины, основанной на генетическом тестировании индивидуальных геномов, неизбежна. Но к ней надо серьезно готовиться не только здравоохранению, но и всему обществу, его многочисленным институтам. Уже сегодня генетическое тестирование заслуживает самого пристального внимания и поддержки не только ученых, медиков, но и ответственных лиц государства. Пока оно носит сугубо вероятностный характер и позволяет получить лишь весьма ограниченную информацию о прогнозе будущих болезней. Но мы уже можем активно выявлять многочисленные функционально неблагоприятные варианты генов, играющих важную роль в ряде онкологических, психических и многих других заболеваний. Известно и уже активно входит в медицинскую практику тестирование генов метаболизма, определяющих особенности индивидуальной чувствительности к лекарственной терапии (фармакогенетика). Достаточно хорошо разработаны и пути, позволяющие полностью устранить или, по крайней мере, свести к минимуму неблагоприятный эффект многих функционально неполноценных генов. Конечно, получение генетического паспорта сопряжено со значительными материальными затратами. Однако быстрое развитие новых методов и технологий, в том числе микрочипов, позволяет надеяться на удешевление таких процедур уже в недалеком будущем. Переход от диагностики к прогнозированию болезни (через тестирование), а от них к предупреждению (комплексу лечебно-профилактических мер) и лечению (строго индивидуальной фармакотерапии) — вот вполне обозримые горизонты предиктивной медицины. Главная цель предиктивной медицины сегодня — научить человека жить в гармонии со своими генами!
Литература
1. Баранов В.С. // Мол. биол. 2004. Т.38. №1. С.1—7.
2. Баранов В.С. // Экологическая генетика. 2004. №1. С.22—29.
3. Баранов В.С., Баранова Е.В., Иващенко Т.Э., Асеев М.В. Геном человека и гены “предрасположенности” (Введение в предиктивную медицину). СПб., 2000.
4. Баранов В.С., Иващенко Т.Э., Швед Н.Ю., Крамарева Н.Л., Асеев М.В. Генетические аспекты профилактики и лечения эндометриоза: Пособие для врачей. СПб., 2004.
5. Москаленко М.В., Асеев М.В., Зазерская И.Е., Кузнецова Л.В., Баранов В.С. // Молекулярно-биологические технологии в медицинской практике. Вып.4. Новосибирск, 2003. С.120—133.
6. Баранов В.С., Асеев М.В., Баранова Е.В. Гены предрасположенности и генетический паспорт // Природа. 1999. №3. С.17—27.
7. Иващенко Т.Э., Стрекалов Д.Л., Соловьева Д.В., Асеев М.В., Баранов В.С., Хавинсон В.Х. Определение генетической предрасположенности к некоторым мультифакториальным заболеваниям. Генетический паспорт: Методические рекомендации. СПб., 2001.
8. Хуснутдинова Э.К., Боринская С.А. Геномная медицина — медицина XXI века // Природа. 2002. №12. С.3—8.