© Голубовский М.Д., Вайсман Н.Я.Парадоксы генов рака у дрозофилы М.Д. Голубовский, Н.Я. Вайсман
Михаил Давидович Голубовский, д.б.н., в.н.с. СПб-филиала Института истории естествознания и техники им.С.И.Вавилова РАН.
Наталья Яковлевна Вайсман, к.б.н., с.н.с. лаб. генетики популяций Института цитологии и генетики СО РАН.
Светлой памяти К.Б.Соколовой Ксения Борисовна Соколова (1946-1996) - талантливый генетик и историк биологии. Изучала действие гена lgl, мутации которого у дрозофилы и других животных приводят к злокачественным опухолям. Впервые установила распространение в популяциях дрозофил разных летальных аллелей этого гена и адаптивность их носителей при температурных стрессах. Автор книги “Развитие феногенетики в первой половине ХХ века” (М., 1998).Известно, что проблема канцерогенеза не нова. Ею занимаются уже много лет, и за это время было высказано множество гипотез, объясняющих появление опухолевых клеток. Но окончательного ответа на этот вопрос до сих пор нет.
В 2005 г. английский генетик Г.Харрис, который еще в 1969 г. предсказал наличие в геноме млекопитающих генов онкосупрессоров, т.е. ответственных за подавление злокачественного деления, опубликовал статью “Волны моды в исследовании рака”. В ней он прослеживает, как примерно каждые 10 лет то или иное открытие, тот или иной подход объявлялись решающими в истолковании причин рака. Появлялась иллюзия, что проблема рака вот-вот будет окончательно решена. Но искушение и соблазн проходили, и вслед за этим возникала другая мода *.
* Заметим, элемент моды в науке сам по себе не одиозен. В конце концов, мода связана со стремлением к новизне, красоте и сопровождает человека тысячелетия. Даже в природных популяциях дрозофилы обнаружена “мода на мутации”. Вот и пришествие в 2005 г. грозного штамма вируса гриппа H5N1 в определенном смысле есть повторение “моды” образца 1918 г. (H1N1).Анализируя их смену во времени, Харрис аргументирует, что причина рака вовсе не в прямом действии онкогенов, не в мутациях клеточного цикла, не сводится полностью к повреждению генов-супрессоров опухолей, и, наконец, рак не возникает как прямой ответ на генетические повреждения генома или в ходе запуска апоптоза - запрограммированной смерти клеток. Харрис указывает на неизбывную трудность в поиске первопричин рака: опухоль - это динамически меняющаяся популяция разнородных клонов. Именно поэтому до сих пор неясно, какие свойства раковых клеток первичные, а какие вторичные, что служит причиной, а что - следствием.Харрис приходит к выводу, что истоки опухолевого роста связаны с мутациями, блокирующими ключевые ступени специализации клеток и тканей. Рак - следствие ошибок дифференцировки, в пользу чего получено множество данных в исследованиях на дрозофиле. Здесь, заключает он, “проведен наиболее тонкий анализ канцерогенеза по сравнению с любым другим организмом, и для меня загадка, почему эти кардинальные работы на дрозофиле не были достаточно оценены исследователями рака” [1]. Попробуем ее разгадать.
Летали, генетика развития и рак
У дрозофилы летальную злокачественную опухоль впервые детально описала Э.Гатефф в 1969 г. [2]. Она показала, что опухоль развивалась в результате появления одной рецессивной мутации гена l[2]gl (lethal giant larvae - летальные гигантские личинки), далее обозначенной как lgl. Сама эта мутация уже была известна. Ее впервые нашли еще в 1930 г. в лаборатории Т.Моргана (нашли, но не изучали). Объектом исследования мутация lgl стала лишь спустя семь лет. Тогда швейцарский эмбриогенетик Э.Хадорн (1902-1976) решил детально изучать разные летальные мутации у дрозофил в плане их биологии развития и феногенетики [3]. Он попытался проследить, на какой стадии и почему у гомозигот по леталям останавливается развитие и можно ли мутантов как-то спасти от гибели. Летальные мутации разных генов различались по стадии преимущественной гибели и по тому, какие ткани и органы повреждались у их носителей. Главным объектом своих экспериментов Хадорн взял ген lgl.
В норме цикл развития дрозофил от яйца до вылета взрослых мух занимает 10 дней. Но у гомозигот lgl-мутантов оно застывало на стадии личинок. Они росли, увеличиваясь в длину почти в два раза, и, наконец, будучи неспособны превратиться в куколку (метаморфоз), погибали через две недели. Хадорн установил, что мутация lgl приводила ко множественным повреждениям разных систем органов. Подсадка мутантам кольцевой железы из мозга обычных личинок частично нормализовала развитие, они претерпевали метаморфоз и превращались в куколок. Кольцевую железу биологи открыли давно, но не ведали ее функции. На основе опытов Хадорна впервые стал ясен функциональный смысл этого органа в развитии насекомых - синтез экдизона, гормона метаморфоза [3]. Далее исследователи, наблюдая у мутантов политенные хромосомы слюнных желез, смогли под микроскопом проследить, как импульсные выбросы гормона вызывают каскадные всплески активности генов, приводя к метаморфозу.
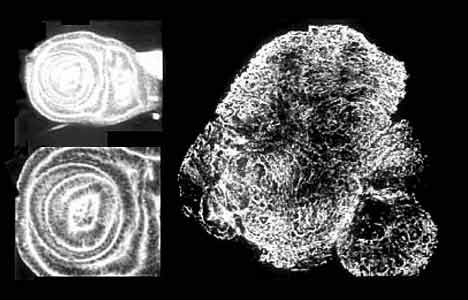
Имагинальный диск дрозофилы.
В норме (слева) эпителиальные клетки концентрически упорядочены (увел. 25 и 50).
У lgl-гомозигот (справа) архитектоника диска нарушается,
и эпителиальные клетки разрастаются в бесформенную массу (увел. 25).Еще в 1960-е годы Хадорн разработал метод подсадки имагинальных дисков личинок (зачатков органов взрослой мухи) в брюшко дрозофил и их длительного культивирования путем пересадок. Так он открыл феномен переопределения судьбы имагинальных дисков, трансдетерминацию, - загадочный и по сию пору. Выбор Хадорном в качестве модели гена lgl оказался плодотворным, независимо от того, был ли он чистой удачей или даром исследователя, способного задать нужный вопрос. В аспекте феногенетики ген lgl среди всех известных у животных леталей, пожалуй, лидирует по важности и изученности на молекулярном, цитологическом, организменном и популяционном уровнях (с ним может сравниться лишь ген короткохвостости у мышей).
Эстафету Хадорна в изучении гена lgl и приняла Гатефф. Как уже говорилось, в 1969 г. она нашла новый летальный вариант lgl и установила, что мутанты погибли от злокачественного перерождения (неоплазии) клеток имагинальных дисков и нейробластов, предшественников нервной ткани мозга. Все виды этих клеток проявляли отличительные признаки опухолей животных и человека: автономность делений и разрастание ткани, их дезорганизацию и способность к метастазам при их трансплантациях взрослым мухам. Мутантные клетки из опухолей имагинальных дисков и мозга личинок при пересадках в брюшко взрослой мухи разрастались, давали метастазы, и дрозофила погибала спустя пять дней.
Это открытие инициировало работы по канцерогенезу на дрозофиле. К 1978 г. нашли уже 12 онкогенных мутаций, поражающих имагинальные диски личинок, нейробласты, мозг и кроветворную систему [4]. В 1985 г. ученики и последователи Хадорна - В.Гилберт и В.Мак-Гиннес - клонировали ген lgl [5]. Тогда же они открыли структуру гомеозисных генов, контролирующих образование сегментов тела у всех беспозвоночных и позвоночных животных. Нормальную копию гена lgl присоединили к мобильному элементу и вставили в геном мутантов. У таких мух опухоли не возникали, развитие шло нормально. Значит, утрата функции гена lgl и есть первопричина образования опухолей у мутантов.
Ген lgl эволюционно консервативен. Его гомологичные копии обнаружены у дрожжей, разных животных, в том числе у человека. Недавно в изящном опыте гомолог гена lgl человека пересаживали мутантным мухам, и они выживали, будучи свободными от опухолей! Мутации этого гена найдены в более чем 70% карцином (опухолей эпителиальных тканей) и почти во всех исследованных случаях меланомы (рака кожи). Гены-гомологи lgl сохраняют сходную функцию опухолеродности у эволюционно далеких видов.
До работ Гатефф большинство исследователей разделяло представление (и до сих пор его придерживается), что рак всегда возникает в результате повреждений многих генов. Однако данные на дрозофиле свидетельствовали, что мутация одного гена способна привести к опухоли. Когда же опухолевые гены у дрозофилы были клонированы, это только добавило скепсиса. Ибо они по своему молекулярному облику не входили в уже известный “джентльменский набор” онкогенов и онкосупрессоров у млекопитающих. Правда, сходные (гомологичные) гены из этого набора были найдены и у дрозофилы, однако их мутации не вели прямым образом к раку или летальности. Гатефф впервые сделала важное концептуальное заключение, что моногенное повреждение, приводящее к опухоли, прямо или косвенно связано с “установлением и поддержанием состояния дифференцировки” [2, 4].
Сегодня очевидно, что анализ канцерогенеза у дрозофилы облегчается рядом ее особенностей как объекта. Во-первых, опухоли у дрозофилы по преимуществу изучаются в эмбриональных и личиночных тканях, т.е. в популяциях клеток, подобных по своему статусу региональным взрослым стволовым клеткам млекопитающих и их дочерним клеткам-предшественницам (или прогениторным), которые дифференцируются в разные клеточные типы. Во-вторых, появление опухолей и поддержание их роста не зависит от возникновения разветвленного кровотока в опухолевой ткани (что столь важно у млекопитающих), ибо органы дрозофилы как бы купаются в питающей их гемолимфе. В-третьих, имеется большая библиотека клонированных генов дрозофилы и разработаны тонкие генетические методы, в том числе для получения мозаичных особей, у которых меченые опухолевые клетки существуют рядом с нормальными. Так что выбор дрозофилы для анализа канцерогенеза приближает к его истокам [6].
К настоящему времени у дрозофилы найдено более 40 генов, утрата функции которых приводит к опухолям в том или ином органе. Эти опухоли делят на доброкачественные и злокачественные. В первом случае наблюдается опухолевое разрастание клеток, которые не утрачивают полностью своей формы и не дают метастазы, однако их дифференцировка нарушается. Мутации эти, как правило, летальны. У злокачественных опухолей (неоплазий) резко меняются форма, адгезионные свойства и архитектоника клеток, а при пересадках возникают метастазы. Удивительно, что мутации lgl приводили к опухолям разных типов тканей: всех форм эпителия, а также нейробластов.
Ген lgl (и еще два сходных гена, обнаруженные во всем геноме дрозофилы) относится к совершенно новому типу онкосупрессоров, не известных ранее у млекопитающих. Его белковый продукт, найденный в цитоскелете, мембране и цитоплазме клеток, вовлечен в две разных функции: структурную - установление и поддержание клеточной полярности; динамическую - участие в сигнальных путях, контролирующих деление клеток и их специализацию.
Молекулярные биологи и биоинформатики обнаруживают большое структурное сходство многих жизненно важных генов у разных организмов. Для понимания их роли в деятельности всей клетки в целом предложен подход, названный генетической онтологией (онтология - учение о сущем). Согласно этому подходу, различают три ипостаси генного действия - молекулярную функцию, клеточные компоненты и биологические процессы. Онтологический спектр гена lgl оказался весьма широк.
Молекулярная функция: связывание с цитоскелетными белками типа миозинов; белок-белковые контакты. Локализация и клеточные компоненты: цитоскелет; мембрана цитоплазмы; оболочка клеток; межклеточные контакты; экзоцитоз и транспорт белков через везикулы (пузырьки) или синапсы в зонах нервно-мышечных контактов. Биологические процессы: асимметричная локализация белков в цитоплазме и на мембране клеток; установление и поддержание полярности в эпителии и нейробластах; морфогенез эпителиальных тканей, их архитектура; сборка белковых комплексов в зонах межклеточных контактов; торможение (супрессия) деления клеток; сигнальные пути (генные сети), которые определяют деление стволовых клеток и их специализацию. Теперь проследим, как утрата функции гена lgl приводит к возникновению опухолей.
Архитектоника клеток, деления и рак
Известный исследователь динамической морфологии клеток Ю.М.Васильев определил клетку как архитектурное чудо и воспользовался удивительной метафорой - “разум цитоскелета” [7]. Кто первый употребил термин “цитоскелет”? Еще в начале века русский биолог Н.К.Кольцов на основании большой серии опытов по изучению свойств жгутиков сперматозоидов пришел к выводу, что в клетке есть скелетные структуры. Однако термин “цитоскелет” широко распространился только в последние два десятилетия. Первоначально предполагалось, что цитоскелетные нити образуют опорный каркас клетки.

Схема организации продукта гена lgl (белка P127) у дрозофилы и его гомолога у человека (Hugl).
Белок P127 состоит из 1161 аминокислоты, которые организованы в домены, отвечающие за различные функции (связывание с белком цитоскелета, фосфорилирование), и три участка по 40 аминокислот, по которым связываются белковые субъединицы. Белок Hugl (1057 аминокислот) имеет множество районов, сходных с онкосупрессором дрозофилы на 75%, и также связывается с цитоскелетом. (По: Lorenzo C. et al.)Цитоскелет несомненно выполняет эту роль, но это лишь одна из многих функций этих структур в клетке. Он, в отличие от обычного опорно-двигательного аппарата организма, во-первых, непрерывно преобразуется и перестраивается в процессе движения и деятельности клетки; во-вторых, вкупе с мембраной клетки выполняет ключевые регуляторно-информационные функции, реагируя с помощью белков-рецепторов на внешние воздействия, запоминая их и определяя социальное поведение клеток [7]. Конструктивную основу цитоскелета составляют два компонента: микрофиламенты из нитей актина и микротрубочки из белка тубулина. Актиновые нити микрофиламентов всегда связаны с сократительными белками типа миозинов, например, продукт гена lgl - с миозином II. Таким образом, lgl вовлечен в морфо-динамические преобразования цитоскелета и мембраны, наблюдаемые в самых разных биологических процессах.Отличительная черта цитоскелетных конструкций из микрофиламентов и микротрубочек - их полярность. Самый известный пример - полярность центров, организующих клеточное деление (центросомы) или полярность нитей веретена, управляющих движением хромосом к разным полюсам. Полярность в еще более яркой степени свойственна архитектонике клеток, в особенности эпителиальных. Эпителий выстилает полости тела (кишечник, легкие), протоки желез (молочных, простаты) и образует защитный слой кожи. Мембрану эпителия пронизывают белки-рецепторы, образуя структурно-информационную систему клеток и тканей - сигнальные пути.
В норме клетки эпителия расположены упорядоченно, чаще всего в один слой. В них, подобно коринфским колоннам, различают верхушечный полюс и основание, в области которого клетки прикреплены к общей подстилке (матриксу). Полюс, находящийся ближе к основанию, называют базальным, а верхушечный - апикальным. Между полюсами упорядоченно расположены три комплекса белков. Часть из них, пронизывая клеточную мембрану, образует два типа поперечных связок: ближе к вершине - опоясывающий контакт из белков катенинов и кадгеринов, а ближе к основанию - щелевой контакт. Там-то и концентрируется продукт гена lgl. Около 12-15 белков, образующих три контактных комплекса, не только эволюционно консервативны по структуре, но и сходны по типу плюс-минус взаимодействий между одноименными комплексами. В этом ансамбле продукт гена lgl действует словно дирижер [8]. Он накапливается в материнской яйцеклетке впрок и обнаруживается в цитоскелете и в мембране на самых ранних стадиях развития.
У мутантов с утратой функции гена lgl нарушается поляризация клеток, дезорганизуется архитектоника эпителия, и вместо парадного строя формируется многослойная и бесформенная клеточная масса. При этом страдают разные типы эпителия (в эмбрионах, имагинальных дисках и фолликуллярных клетках), которые управляют ростом и формированием яйцеклеток. Ранее полагали, что бесформенность опухолевых клеток вторична и возникает как бы сама собой после приобретения ими способности к неконтролируемому делению. Опыты по получению генетических мозаиков (этот метод хорошо разработан именно на дрозофиле) показали, что если некие клетки сделать гомозиготными по мутации lgl, но поместить их в окружение нормальной эпителиальной ткани, то деления клеток ограничиваются и опухоли не возникают (подобно тому, как утрата координации одного солдата не нарушает всего их парадного строя). Нарушение же системы контактов из-за поломки “архитектурного” гена (команда “вольно”) может стать пусковым механизмом к нерегулируемым делениям и асоциальному поведению клеток [8].
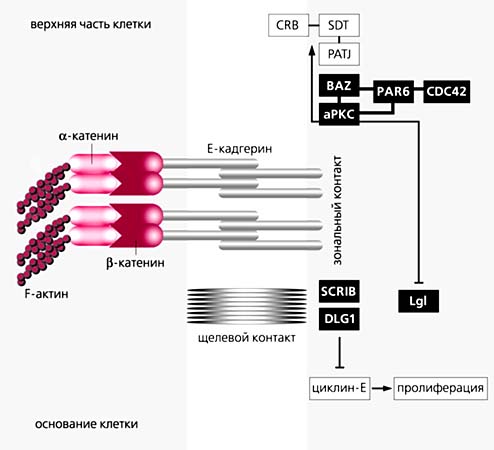
Контакты эпителиальных клеток и их ген-белковые комплексы.
Примерно 12-15 белков образуют три контактных комплекса, которые сходны у дрозофилы и человека по своему составу, полярности и типу взаимодействий. Ближе к вершине клеток белки катенины и кадгерины формируют опоясывающий зональный контакт (слева); справа указаны белки, участвующие в щелевом контакте, у основания которого локализуется ген lgl. (По: Brumby A., Richardson H. // Nature Rev. Cancer. 2005. V.5. P.626-639.)Нейробласты, опухолевый рост которых приводит к появлению нейробластом при мутациях lgl, аналогичны взрослым стволовым клеткам нервной ткани. Асимметричность делений - их особенность. Неравные деления проходят две стадии: на первой одна из дочерних клеток нейробласта остается неизменной, а другая дает клетку-предшественницу, или прогениторную, которая вступает на путь специализации. Прогениторная клетка дифференцируется либо в нейроны, либо в глиальные клетки мозга. На каждом этапе неравных делений судьба клетки зависит от структурной или архитектурной асимметрии - полярного распределения белков-морфогенов в сочетании со сменой полюсной ориентации нитей веретена деления. Сначала возникает “материальное” неравенство, а затем - функциональное.У мутантов lgl нейробласты не могут начать дифференцировку и разрастаются в опухоль. Эта аномалия характерна не только для дрозофилы, но и для млекопитающих. Генно-инженерное выключение (“нокаутирование”) функции гомологичного гена lgl у мышей ведет к нарушению асимметрии в распределении белков-морфогенов нервной ткани, аномальной дифференциации, опухолям и в конце концов к смерти новорожденных мышат [9].
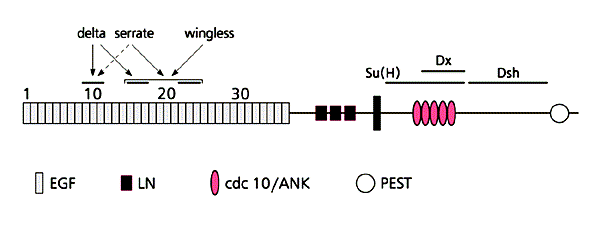
Организация трансмембранного белка NOTCH.Белок-димер (~3 тыс. аминокислот), пронизывающий клеточную мембрану, имеет два основных участка. Внешний (36 повторов по 38 аминокислот) связывается с универсальным сигналом клеточного деления - молекулой эпидермального фактора роста EGF. К этим же повторам присоединяются молекулы лигандов, контролируемых генами delta, serrate, wingless; за счет чего между соседними клетками происходит латеральное ингибирование, определяющее их судьбу. После присоединения сигнальной молекулы белок NOTCH подвергается действию протеаз и других белков Dx, Dsh; его внутриклеточный сегмент активизирует многофункциональный белок-посланник Su(Hw), который переходит в ядро и активирует транскрипцию генов-мишеней. Асимметричное распределение молекул в процессе делений стволовых клеток влияет на активность NOTCH в прогениторных клетках и отвечает за их судьбу. (По: Arias A.M. // TIG. 2002. V.18. P.168-170.)Проиллюстрируем более конкретно участие гена lgl в сигнальных путях или генных ансамблях, определяющих специализацию клеток при делениях. В дифференцировке нейробластов роль первой скрипки играет эволюционно-консервативный ген Notch [10]. Мутация Notch (произносится “ночь” и в переводе с английского значит “остроконечная вырезка” - по этой аномалии крыла ген обнаружили у дрозофилы еще на заре генетики) сразу привлекла внимание своим необычным генетическим и хромосомным поведением. По фенотипу она доминантна в гетерозиготе по отношению к норме, а Notch/Notch гомозиготы погибают на самых ранних стадиях развития. Оказалось, что в хромосомах мутантов ген Notch напрочь отсутствует. Значит, наследуемая аномалия крыла вызвана утратой одной дозы нормального гена. У дрозофил одной дозы хватает для выживания, но не для нормального хода развития. А вот у мышей и гетерозиготы Notch/+ не выживают. Подобные гены, нехватка которых у гетерозигот приводит к доминантным отклонениям в развитии или гибели, именуют гапло-недостаточными (часть “гапло” означает одну дозу гена или генома). Эти гены немногочисленны, но они необычайно ценны для изучения генетики развития.Гатефф обнаружила, что трансплантация тканей от погибающих эмбрионов, мутантов по Notch, ведет к опухолевому росту. Онтология гена notch обширна и занимает полстраницы: он кодирует белковый рецептор универсального сигнального пути, который определяет судьбу клеток самых разных тканей во всем животном мире, от нематоды до человека [10].
Белок NOTCH пронизывает мембрану и состоит из трех разных доменов. Внешний представляет собой рецептор, куда присоединяются лиганды - фактор роста и другие сигнальные белки. После присоединения сигнального белка от внутриклеточного домена NOTCH отщепляется, словно хвост ящерицы, домен-посланник, который, направляясь из цитоплазмы в ядро, передает сигнал на уровень транскрипции ДНК.
Когда NOTCH активен, клетки нейроэпителия превращаются в функционально различающиеся ткани мозга и нервной системы: нейроны и глию. Чтобы одна из дочерних стволовых клеток нейробласта вступила на путь дифференцировки, в ней должен накопиться также особый белок-морфоген (NUMB), который подавляет активность NOTCH. В этом случае вместо дифференцировки возникают неупорядоченные деления, способные в конце концов привести к опухоли. Асимметричное распределение белка-морфогена нейробластов зависит от нормальной функции гена lgl. При ее утрате обычная асимметрия распределения морфогенов нарушается, дезорганизуется сигнальный путь NOTCH и нейробласты начинают неконтролируемо размножаться.
Недавно исследователи решили подобраться к первоистокам рака с другой стороны туннеля: т.е. проверить, не будут ли мутации, нарушающие полярность стволовых клеток, приводить к трансплантируемым опухолям. Выбрали мутации с разными аномалиями асимметричного деления нейробластов - неравным распределением белков-морфогенов или поворотом веретена митотического деления. Оказалось, что у взрослых мух после трансплантации нейробластов таких мутантов возникала злокачественная опухоль, которая поддерживалась через последовательные пересадки более двух лет. Через шесть недель после первой трансплантации в клетках перевиваемых опухолей обнаружились хромосомные перестройки, столь типичные для опухолей млекопитающих. Очевидно, что нестабильность генома в данном случае появилась после возникновения канцерогенности в потомстве мутантных нервных стволовых клеток [11].
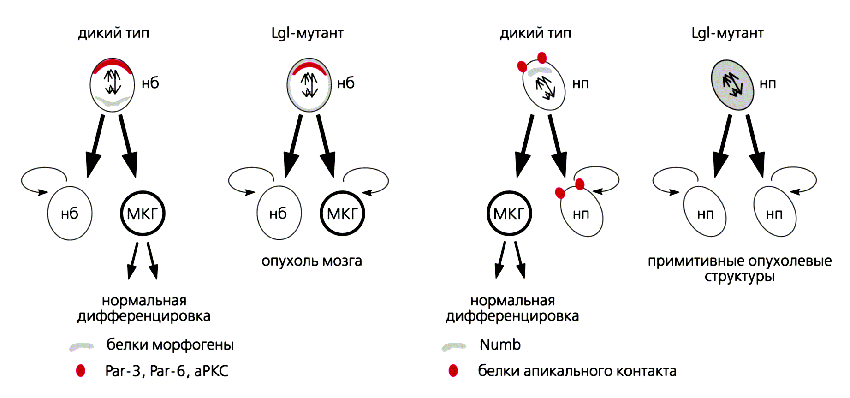
Участие белка Lgl в асимметричном делении нейробластов дрозофилы (слева) и нейральных прогениторных клеток мозга млекопитающих.В нейробластах (нб) дрозофилы Lgl необходим для базальной локализации белков-морфогенов (Numb, Miranda и Prospero) и асимметрии митотического веретена и клеточного деления. Клетки, утратившие его, неспособны к правильной дифференцировке и завершению клеточного цикла и вступают на путь опухолевого роста. В нейральных прогениторных клетках (нп) мыши белок Lgl1 поддерживает стабильность белкового комплекса апикального межклеточного контакта и асимметричного расположения Numb. При недостатке Lgl1 образуются розеткоподобные структуры, напоминающие начальные стадии нейроэктодермальной опухоли человека. МКГ - материнские клетки глии. (По: Vasioukhin V. // Dev. Newirosci. 2006. V.28. P.13-24.)В начале 2006 г. в исследованиях на клонах нейробластов дрозофилы получены прямые данные о том, какое из двух загадочных свойств этих стволовых клеток нарушается при мутациях lgl: способность к самообновлению или свойство дифференцировки, образование дочерней прогениторной клетки. Оказалось, что lgl-мутация блокирует дифференцировку нейробластов: они начинают делиться только симметрично, их популяция растет, приводя в конце концов к опухоли. Другой изученный авторами ген под названием “атипичная протеинкиназа” (aPKC), находящийся с геном lgl в тесных плюс-минус взаимодействиях, блокировал при мутациях способность нейробластов к самообновлению [12]. Это, несомненно, очень интересный вывод.Воспользуемся далее спортивной метафорой. Долгий путь изучения первого опухолевого супрессора lgl, открытого Э.Гатефф почти 40 лет назад, завершается в последние пять лет стремительным спуртом. Исследования этого онкосупрессора на молекулярном клеточном и организменном уровне привели к новым открытиям в канцерогенезе: главной роли генов клеточной полярности и регулируемых ими асимметричных делений стволовых клеток в возникновении опухолей. Но до финиша далеко. К тому же помимо трех указанных уровней исследований (молекулы, клетки, организм) есть еще один важный аспект изучения генов, приводящих к раку, - их поведение в природных популяциях. Читая свежую работу американских авторов о роли lgl в делениях стволовых клеток [12], мы обратили внимание на приятную пикантную деталь. Авторы использовали мутацию lgl с индексом lgl334. Эта леталь была выделена в ходе генетико-популяционных исследований из популяции Умани (Украина) в старозаветном 1965 г., а затем К.Б.Соколова изучала ее действие в ходе развития. О том, как состыковались работы по генетике популяций и генетике рака и почему эта и другие lgl летали оказались в лабораториях разных стран - в следующей статье.
Литература
1. Harris H. // BioEssay. 2005. V.27. P.833-838.
2. Gateff E. et. al. // Int. J. Dev. Biol. 1996. V.40. P.149-156.
3. Соколова К.Б. Развитие феногенетики в первой половине XX века. М., 1998.
4. Gateff E. // Science. 1978. V.200. P.1448-1449.
5. Mechler B.M., McGinnis W., Gering W. // EMBO J. 1985. V.4. P.1551-1557.
6. Brumby A.M., Richardson H.E. // Nature Cancer Rev. 2005. V.5. P.626-639.
7. Васильев Ю.М. // Соровский общеобразов. журн. 1996. №2.
8. Bilder D. // Genes Dev. 2004. V.18. P.1909-1925.
9. Klezovitch O., Fernandez T. E., Tapscott S.J., Vasioukhin V. // Genes Dev. 2004. V.18. P.559-571.
10. Вайсман Н.Я. // Журн. общ. биол. 2004. Т.65. №4. С.322-333.
11. Caussinus E, Gonzales C. // Nature Genet. 2005. V.37. P.1125-1129.
12. Lee Cheng-Yu., Robinson K.J., Doe C.Q. // Nature. 2006. V.439. P.594-598.