№11, 2003 г.
60 лет Институту кристаллографии им.А.В.Шубникова РАН
© Ю.А. Владимиров
Зачем нужна белковая кристаллография
Ю.А. Владимиров
Юрий Андреевич Владимиров, академик РАМН,
зав. каф. биофизики РГМУ,
зав. каф. физико-химических основ медицины; факультета фундаментальной медицины МГУ им.М.В.Ломоносова,
зав. лаб. белковой кристаллографии Института кристаллографии РАН,
рук. отд. биофизики Научно-исследовательского института физико-химической медицины Минздрава РФ.Строение белковых кристаллов исследуют в основном, используя явление дифракции рентгеновских лучей. Расшифровав строение элементарных ячеек кристалла, мы узнаем структуру образующих их молекул. Иногда это одна молекула (иногда несколько), но главное, что расположение в ней многих сотен или тысяч атомов одинаково в кристалле, растворе и в живой клетке. Изучая создание рук человека - белковый кристалл, мы познаем устройство и способ функционирования белков, из которых в течение двух миллиардов лет было построено все живое на Земле.
Белок под рентгеном
Белковая кристаллография стала возможной, после того как биохимики научились выделять достаточно большие количества чистого белка и выращивать качественные кристаллы. Эта процедура требует тщательности и времени, а успех во многом зависит от таланта и находчивости экспериментатора. Тем не менее к настоящему времени получены кристаллы нескольких тысяч различных белков.
Первую рентгенограмму кристаллов пепсина получили в 1934 г. английские ученые Джон Бернал и Дороти Хочкин. Наличие четкой дифракционной картины (системы рентгеновских пятен, или рефлексов) показало, что все молекулы белка имеют одинаковую упорядоченную структуру [1]. В рентгеноструктурном анализе параллельный пучок рентгеновских лучей направляется на кристалл, где рассеивается атомами. В результате строго периодического расположения рассеивающих центров возникает дифракция лучей и появляются рефлексы. Их интенсивность служит исходным материалом, по которому восстанавливается конфигурация рассеивающего ансамбля. Однако расшифровать строение белка на основании дифракционной картины не могли, пока не знали, как определять фазы рассеянных рентгеновских лучей. Эту задачу решил М.Перутц с сотрудниками в 1954 г., используя рентгенограммы производных кристаллов, содержащих атомы тяжелых металлов в месте их связывания белковыми молекулами. С помощью такого метода изморфного замещения Дж.Кендрью с сотрудниками в 1958 г. получили пространственную конфигурацию миоглобина с разрешением 6A [2], а еще через два года - с разрешением 2 A. Одновременно Перутц с сотрудниками установили строение гемоглобина с разрешением 5.5 A [1].
В нашей стране изучение структуры белков методами рентгеновской кристаллографии и электронной микроскопии было начато Б.К.Вайнштейном с сотрудниками в 1959-1960 гг. в лаборатории структуры белка, созданной в Институте кристаллографии АН СССР. В 1975-1978 гг. расшифровали структуру растительного аналога гемоглобина, леггемоглобина, сначала с разрешением 5 A, а затем 2.8 A (рис.1). К настоящему времени в этой лаборатории определена структура 46 белков, причем для восьми из них с атомным разрешением, т.е. близким к одному ангстрему [3].

Рис.1. Кристаллы некоторых ферментов (слева) и вирусов, полученные в Институте кристаллографии РАН.
Чем совершеннее кристалл, тем выше может быть разрешение. Для выявления структур порядка одного ангстрема необходимы кристаллы размером около 0.5 мм в каждом измерении. Кроме того, кристаллы должны быть без дефектов. Один из нетривиальных путей - это их выращивание в условиях невесомости, т.е. в космосе. Действительно, такие опыты, проведенные в том числе и российскими химиками, показали, что в некоторых случаях в космосе качество кристаллов более высокое, скорее всего благодаря отсутствию гравитации, вызывающей конвекцию жидкости, которая мешает правильному росту кристалла.
В настоящее время в Международной базе белковых данных хранятся более 22 тыс. структур, из которых около 5 тыс. - сами белки, а остальные - их производные (комплексы с субстратами, ингибиторами и т.д.) [4]. Знания структуры белков составляют основу современной энзимологии, молекулярной биологии и молекулярной теории эволюции, патологии, а также позволяют планировать создание новых лекарств и сверхминиатюрных элементов компьютеров будущего.
Переносчики кислорода
и проблема эволюции белковГемоглобины выполняют в природе функцию запасания и транспорта кислорода с помощью простетической группы - гема, комплекса двухвалентного железа с протопорфирином IX. Рентгеноструктурные исследования этих белков показали, что все они имеют одинаковую укладку (миоглобиновую свертку) полипептидной цепи и организованный схожим образом активный центр (рис.2).
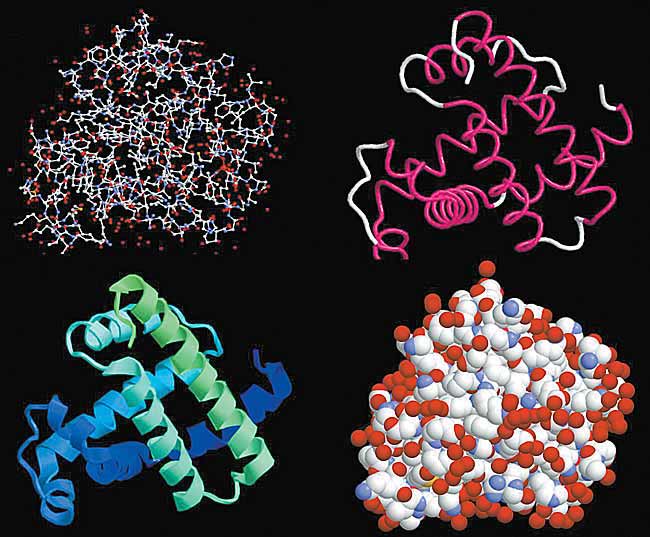
Рис.2. Компьютерные изображения структуры белка миоглобина.
1 - атомы в виде небольших сфер разного цвета: красные - кислород, белые - углерод, синие - азот, желтые - сера. Атомы водорода очень слабо рассеивают рентгеновские лучи и на изображении их нет. Красные сферы по краям белковой молекулы - это кислородные атомы структурированной воды, прочно связанной с белковой глобулой.Уже на примере гемоглобинов стала понятной старая проблема биохимии: зачем для такого простого действия, как связывание маленькой молекулы кислорода или катализ химического превращения молекул (в основном тоже небольших), нужна огромная белковая молекула. Дело в том, что, свертываясь в клубок (глобулу), полипептидная цепь формирует в определенном месте пространственную структуру, идеально приспособленную для связи с субстратом, а затем (в ферментах) - для специфического катализа. С помощью рентгеноструктурного анализа точно определено пространственное строение активных центров и их комплексов с субстратами, без чего нельзя объяснить ни механизм связывания субстратов, ни их химические превращения в биологических объектах.2 - общий ход полипептидной цепи. Участки a-спирали выделены красным цветом, неструктурированные петли цепи - белым цветом.
3 - спиральные структуры в виде лент.
4 - атомы даны как сферы с радиусами Ван-дер-Ваальса.
Рассматривая рисунки 1-3, можно подумать, что полипептидная цепь уложена рыхло и потому обладает большой подвижностью. Но это не так: белковая глобула выглядит как плотная гроздь атомов, лишенных возможности свободного перемещения (4).
В последние десятилетия стало ясно, что в основе развития целых организмов лежит эволюция их белковых молекул. Причина изменчивости белков очевидна: это мутации, изменения в геноме, в результате которых меняется первичная структура белков, т.е. аминокислотная последовательность полипептидных цепей, формирующих белковую глобулу. Но при этом вовсе не обязательно изменение пространственной (третичной) структуры. Не только активные центры леггемоглобина, миоглобина и гемоглобина устроены сходным образом, но и укладка полипептидных цепей у них практически одна и та же (рис.3). При этом полезно вспомнить, что общие предшественники могли породить гемоглобин и миоглобин, встречающиеся у животных, и леггемоглобин растений не менее чем 1.3 млрд лет назад. За это время первичная структура белков сильно изменилась, а пространственная осталась почти неизменной, с небольшими различиями - в той мере, в которой новая функция белка (для леггемоглобина это связывание кислорода, необходимого для фиксации азота в клубеньках) потребовала другого сродства к субстрату. Действительно, по сродству к кислороду отдельные представители семейства гемоглобинов различаются более чем в 105 раз, что соответствует изменению в энергии связывания О2 на 7 ккал/моль [1].
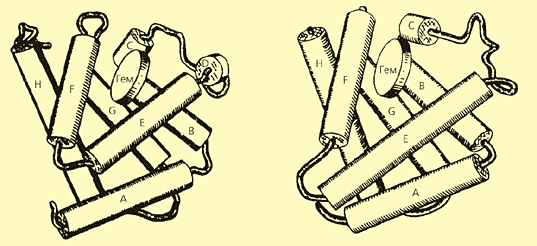
Рис. 3. Общность строения миоглобина (слева) и леггемоглобина (справа).
a-спиральные участки полипептидной цепи показаны в виде цилиндров. (По Б.К.Вайнштейну [3]).
Работа ферментов
Одной из первых в нашей стране была расшифрована структура фермента каталазы, который разлагает перекись водорода на воду и кислород. Наиболее известны каталазы, в активный центр которых, как и у гемоглобинов, входит гем (рис.4). Однако строение активных центров у этих белков существенно отличается, что определяет специфичность их функций. Типичная гемовая каталаза имеет большую молекулярную массу (250-300 кДа) и обладает очень высокой каталитической активностью: почти каждое столкновение макромолекулы с субстратом заканчивается разложением субстрата. В молекуле каталазы четыре субъединицы сложены таким образом, что N-концевой участок полипептидной цепи каждой субъединицы проходит сквозь петлю, связывающую гемсодержащий домен одной субъединицы с доменом, включающим спиральный участок соседней. По правде говоря, до конца непонятно, зачем каталаза такая большая, если ее субстрат - крошечная молекула, да и активный центр тоже большим не назовешь.

Рис. 4. Фотография участка модели каталазы. Стержни - химические связи. Шарики на концах стержней - атомы.
Красный шарик в центре - атом железа в геме.
Красной проволокой обозначен ход полипептидной цепи в a-спирали.Зная строение активного центра (рис.5) и способ встраивания в него субстрата, можно понять механизм катализа (превращения двух молекул пероксида водорода в одну молекулу воды и одну молекулу кислорода). Да и некоторые особенности строения молекулы в целом также можно объяснить. Внутри этого гиганта имеются значительного размера каналы и полости (самая большая радиусом ~7 A). Полости не сообщаются с поверхностью молекулы и обеспечивают, видимо, диффузию субстрата к реакционному центру. Два канала, главный и минорный, подходят к дистальной полости, где размещаются субстрат, продукты реакции или ингибитор. Главный канал (длина 30 A, сечение на поверхности молекулы 15 A) имеет форму конуса, сужаясь при приближении к месту реакции, так что доступ к гему для больших молекул ограничен, а для пероксида водорода - свободен. Внутренняя поверхность каналов выложена гидрофобными остатками (вероятно, чтобы полярные молекулы к ним не “прилипали”).
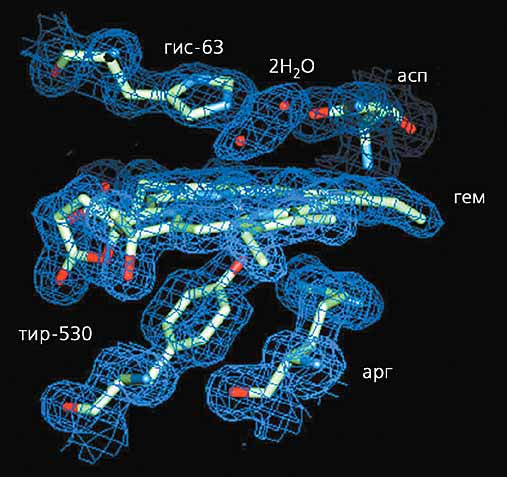
Рис. 5. Активный центр каталазы Penicillium vitale с двумя молекулами воды,
включающий гем (плоская группа в центре рисунка), аминокислотные остатки гистидина и аспарагина (вверху),
и аминокислотные остатки тирозина и аргинина (внизу).Может показаться, что такой сложный фермент не нужен: ведь соли многих металлов переменной валентности (например, железа или меди) тоже разлагают H2O2. Однако при этом образуются свободные радикалы гидроксила, чрезвычайно активного соединения, способного повредить живую клетку. Так появились каталазы - защитные ферменты от перекиси водорода, которая всегда образуется в живых клетках. И сложное устройство этого белка, надо думать, не случайно.
Как и семейство гемоглобинов, гемсодержащие каталазы имеют свою, уникальную пространственную организацию, неизменную в течение эволюции. Во всех изученных гемовых каталазах укладка полипептидной цепи одинаковая, названная каталазным типом свертывания. С другой стороны, из сравнения гемоглобинов и каталаз видно, насколько свойства гема зависят от природы белковой глобулы: гем в разных белках выполняет разные функции.
Существуют каталазы, построенные из совершенно других цепей аминокислот и имеющие иной активный центр, в который входят два атома марганца, но отсутствует гемовая группа. Пространственную структуру димарганцевой Т каталазы из термофильной бактерии Тhermus thermophilus определили в лаборатории Б.К.Вайнштейна в 1986-2000 гг. последовательно, при разрешении 3 и 1.0 A. Ее молекула (молекулярная масса 200 кДа) состоит из шести идентичных субъединиц, образующих гексамер. Анализ структуры области активного центра позволил предложить механизм расщепления перекиси водорода [5]. Несмотря на разительные отличия в структуре, обе описанные каталазы выполняют одну и ту же функцию.
Потоки электронов в клеточных структурах
Рентгеновские волны рассеиваются электронами, которые прочно привязаны к ядрам соответствующих атомов и самостоятельного интереса как бы не представляют. Но в последнее время непрерывно растет интерес к судьбе именно электронов в биологических структурах вообще и в белковых молекулах, в частности. Ведь белки обеспечивают перенос электронов от субстратов окисления на молекулу кислорода, в результате которого клетка получает необходимую ей энергию. Иными словами, сегодня стремительно развивается молекулярная и клеточная биоэлектроника - новое научное направление, в котором изучается движение электронов в биологических объектах, в том числе в мембранных структурах (клеточная биоэлектроника) и макромолекулах (молекулярная биоэлектроника) и создаются биоматериалы для обработки и хранения информации.
Как раздел биологической науки молекулярная биоэлектроника - прежде всего часть биоэнергетики, поскольку основной источник энергии для живой клетки и организма в целом - это энергия, высвобождающаяся в ходе многоступенчатого переноса электронов по белковым и небелковым переносчикам во внутренних мембранах митохондрий аэробных организмов, в так называемой дыхательной цепи (рис.6). Изучение механизмов переноса электронов в макромолекулах и между макромолекулами - важная составная часть биохимии и биофизики как теоретических дисциплин. Для медицины и ее теоретической основы, патологии, главный вопрос - это механизмы нарушения нормального потока электронов в дыхательной цепи и его последствия для жизнедеятельности клетки и всего организма.
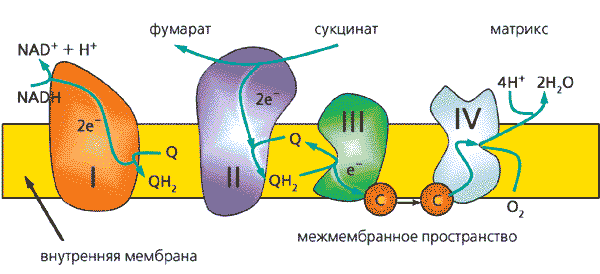
Рис. 6. Схема строения дыхательной цепи во внутренней мембране митохондрий человека.Митохондрии осуществляют важнейшую для биоэнергетики клетки реакцию: фосфорилирование АДФ с образованием АТФ за счет энергии окисления молекулярным кислородом органических соединений, служащих субстратами окисления. Конечная стадия процесса - перенос электронов от восстановленных пиридиннуклеотидов или сукцината на молекулярный кислород - осуществляется по системе переносчиков электрона- дыхательной цепи. Римскими цифрами обозначены дыхательные комплексы, на которые мембраны митохондрий впервые разделил Д.Грин; строчными буквами - цитохромы (остальные сокращения общеприняты в биохимии).Наконец, в технике биоэлектроника обещает найти применение (и уже отчасти его находит) для создания приборов и их элементов на основе таких сверхминиатюрных электронных устройств, как изобретенные самой Природой белковые молекулы. Здесь ключевой аспект - это создание взаимодействия биологических материалов с электронными устройствами.В дыхательной цепи электроны преодолевают по молекулярным масштабам довольно большие расстояния (многие десятки ангстрем, см. рис.7). Как же они это делают? В 40-е годы Н.Риль предположил, что белки обладают полупроводниковыми свойствами и потому электроны могут перемещаться по так называемым зонам проводимости. Эта идея, поддержанная лауреатом Нобелевской премии А.Сент-Дьердьи, приобрела некоторую популярность. Однако имеющиеся экспериментальные данные [6] и результаты измерения фотопроводимости белковых пленок [7] показали, что белки скорее изоляторы.
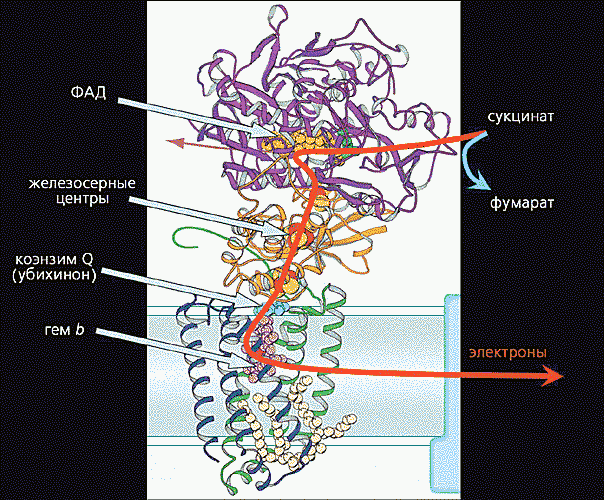
Рис. 7. Перенос электронов внутри комплекса II.
Электроны поступают от янтарной кислоты (сукцината), которая в ходе окисления углеводов в цикле трикарбоновых кислот превращается в фумаровую кислоту. Вначале электроны восстанавливают флавинадениндинуклеотид (ФАД), а затем последовательно передаются на другие коферменты: три железосерные центра, коэнзим Q и гемовую группу цитохрома b. Путь (примерно 70 A) электронов внутри комплекса показан красной стрелкой.Согласно современным представлениям, перенос электронов внутри белковых молекул может осуществляться двумя путями: с помощью эстафетной передачи между подвижными доменами и благодаря туннельному эффекту.Рассмотрим механизм эстафетной передачи на примере дыхательного комплекса III (комплекс bc1). Анализ белковой кристаллографии и ряда других результатов показал, что на участке гем цитохрома c1 ® ® 2Fe2S-центр ® гем bL цитохрома b электроны переносятся путем последовательного взаимодействия железосерного центра сначала с гемом цитохрома c1, а потом с гемом bL цитохрома b (рис.8).
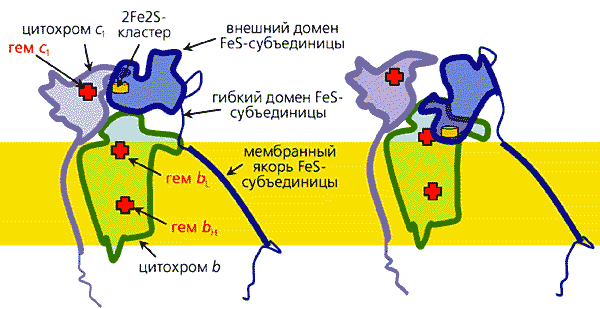
Рис. 8. Эстафетный перенос электронов в комплексе bc1.Полярная часть домена 2Fe2S-кластера прикреплена к якорной части домена гибкой полипептидной петлей, что придает достаточную подвижность полярной группе, и в результате тепловых движений она сталкивается то с донором (гемом цитохрома c1), то с акцептором электрона. Схематически изображены контуры белков, входящих в комплекс bc1 дыхательной цепи митохондрий (комплекс III). Слева - расположение цитохромов c1, b и субъединицы комплекса, содержащей железосерные кластеры, в момент, когда 2Fe2S-центр сближен с гемом цитохрома c1 и получает от него электрон. Справа - головка 2Fe2S-субъединицы в водной фазе повернута таким образом, что железосерный центр сближен с одним из гемов цитохрома b и может отдать ему электрон.Однако движение электронов между достаточно удаленными центрами осуществляется другим путем: вследствие так называемого туннельного эффекта, в результате которого частица может “просочиться” через потенциальный барьер. Эффективность туннельного переноса зависит от диэлектрических свойств среды: она повышена в неполярном окружении и снижена в поляризуемой среде. Расчеты, основанные на знании атомной структуры белковых молекул, показывают, что в пределах белков - переносчиков электронов - можно выделить “туннели”, или “трубы”, по которым будет преимущественно переноситься электрон (рис.9). Таким образом, можно сказать, что белки представляют собой электронные устройства, внутри которых имеются “провода”. Кроме того, как уже говорилось, некоторые белки обладают подвижными группами, способными в результате тепловых движений переносить электрон между двумя другими коферментами.
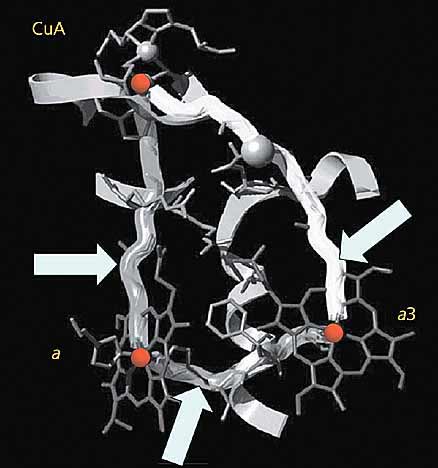
Рис. 9. Туннельные трубы, по которым идет транспорт электронов в цитохромоксидазе.
Стрелками обозначен туннельный перенос электронов между CuA и гемом цитохрома a (левая труба); между CuA и гемом цитохрома a3 (правая труба) и между этими двумя электронными потоками (нижняя труба).Совершенная организация систем переноса электронов в биологических мембранах, точнее, в белках-переносчиках электронов не роскошь, а суровая необходимость. Органические молекулы, из которых построено наше тело, имеют на орбиталях только спаренные электроны, химическая активность которых как бы взаимно скомпенсирована. Но если одинокий (неспаренный) электрон, путешествующий по системе электронного транспорта, вдруг “заблудится” и присоединится к органической молекуле или, например, к молекуле кислорода, образуются высокоактивные свободные радикалы, способные повреждать и разрушать биологические структуры.В последние годы интерес к свободным радикалам чрезвычайно вырос не только в среде биологов, но и практикующих врачей. Сегодня свободные радикалы считают одной из главных причин всех так называемых болезней пожилого возраста, включая нервные заболевания, например старческое слабоумие и болезнь Паркинсона, а также иммунные расстройства, атеросклероз, рак, ревматоидный артрит, гипертензию и диабет.
Одна из основных причин усиленного образования радикалов - нарушение нормального транспорта электронов по дыхательной цепи митохондрий. Проблема в том, почему это происходит? Известно, что поврежденные митохондрии, как и митохондрии пожилых людей и старых животных, образуют больше радикалов кислорода, чем митохондрии молодые и здоровые. Но что именно ломается в дыхательной цепи и почему? Сравнение структур и биохимических свойств двух родственных белков-переносчиков электронов, сукцинатдегидрогеназы и фумаратредуктазы [8], показало близость их строений, а значит, и функций. Однако в качестве побочного продукта фумаратредуктаза производит в 25 раз больше радикалов кислорода. Это объясняется тем, что при работе дыхательной цепи в сукцинатдегидрогеназе электроны быстро оттекают от флавинадениндинуклеотида на [3Fe-4S]-кластер и на цитохром b, благодаря чему их избыток составляет в среднем 0.2 электрона, у фумаратредуктазы в силу большего расстояния между центрами переноса электронов их отток происходит заметно медленнее, отчего там оказывается лишний электрон (1.0) и вероятность его переноса на молекулы кислорода резко возрастает. Мутации, приводящие к нарушению структуры полипептидной цепи в сукцинатдегидрогеназе, усиливают выделение радикалов кислорода, и, как следствие этого, развиваются генетические болезни [8].
От знаний - к созиданию
Сегодня определение структуры белков входит в практику фармацевтических исследований, причем самые большие фармацевтические компании располагают соответствующим оборудованием для кристаллографии. Недавно появились небольшие компании, которые специализируются на структурных исследованиях, используя современные автоматизированные технологии (называемые high-throughput).
Знание трехмерной структуры белков-мишеней - отправная точка для конструирования лекарств с помощью топографии контактирующих поверхностей лиганда (связываемой молекулы, например субстрата, ингибитора или лекарства) и его белковых мишеней. Эти две поверхности должны повторять форму друг друга и содержать как можно больше точек притяжения - противоположных зарядов, участников водородных связей или просто гидрофобных групп. Такая информация может помочь химикам синтезировать новые вещества, которые должны лучше взаимодействовать с белками. Такие препараты будут более эффективными и избирательными. В продаже уже есть лекарства, созданные так называемым методом драг-дизайн (конструирование лекарств). К ним относятся препараты против вируса иммунодефицита человека, такие как ампренавир (Agenerase) и нелфинавир (Viracept), полученные на основе использования структуры кристаллов ВИЧ-протеазы (рис.10).
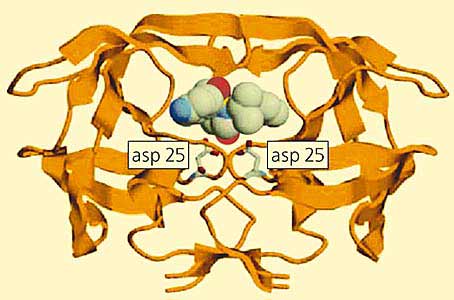
Рис.10. Пример драг-дизайна, основанного на знании третичной структуры белка–мишени.
ВИЧ-протеаза представлена в формате полосок, а ингибитор ампренавир - в виде атомов с радиусами Ван-дер-Ваальса. Выделены цветом аспарагиновые остатки в активном центре.Один из способов “подгонки” структуры лекарственного препарата к ложу для субстрата, расположенному в центре белка-мишени, - последовательный подбор фрагментов будущего лекарства перед окончательным синтезом. Вначале с помощью компьютерных программ подбирают молекулярные фрагменты, соответствующие форме и свойствам поверхности полости в активном центре белка. Пространственную структуру таких молекул (обычно небольших), как правило, находят в базе данных малых органических молекул. Чтобы убедиться в том, что отобранный фрагмент действительно вписывается в активный центр белка, проводят рентгеноструктурное исследование: его растворяют (обычно в диметилсульфоксиде) и добавляют к изолированному белковому кристаллу. Примерно через час молекулы проникают в активные центры кристаллического белка и можно начинать дифракционный эксперимент. Найдя несколько фрагментов, заполняющих разные области активного центра, синтезируют окончательную молекулу лекарства так, чтобы она вся оптимально встраивалась в молекулу-мишень. Таким образом осуществляется “стыковка” лекарства с белком-мишенью. Хотя большую часть этого процесса осуществляет компьютер, кристаллографическое исследование структуры необходимо как для его начала, так и для его завершения.В истории фармацевтики методом драг-дизайна изучено приблизительно 500 мишеней. Это не так уж мало, тем не менее возможности еще далеко не исчерпаны. Следует помнить, что в геноме человека содержится 40 тыс. генов, что соответствует даже большему количеству белков, которые могут быть синтезированы. Многие из них (если не большинство) - потенциальные мишени для новых лекарств различных молекулярной массы и структуры, а главное - разнообразного действия.
Открываются перспективы использования белковой кристаллографии и в других областях практической деятельности, в частности, в вычислительной технике. Здесь большие надежды возлагаются на светочувствительные белки - родопсин или бактериородопсин как ячейки памяти. Вместо электрического потенциала записывающим сигналом может быть луч лазера, другой луч используется, чтобы обнаружить изменения в данной ячейке. Так, бактериородопсин из галофильной водоросли под действием света переходит из одного исходного состояния (назовем его формой B) в другое (форму M), при этом изменяется его поглощение. В блоке трехмерной памяти молекулы бактериородопсина помещены в гель. Благодаря устройствам фокусировки и развертки лазерных пучков в каждый момент времени свет попадает на одну определенную молекулу. Первый луч - записывающий, второй - считывающий. Поскольку размер ячейки очень мал, память, построенная на бактериородопсине, существенно выше, чем на полупроводниковых материалах, как по плотности записи, так и по быстродействию.
Для медицины весьма полезны были бы сверхминиатюрные роботы, способные проникать в любое место нашего организма, в мельчайшие кровеносные сосуды и даже внутрь определенных клеток. Расшифровка структуры белков привела к интересному выводу: самые миниатюрные механические, оптические и электрические приборы и машины давным-давно созданы Природой. Например, вращающаяся часть фермента АТФазы из митохондрий и бактерий. Сам фермент можно рассматривать как крошечный электромотор, использующий энергию электричества, правда не электронов в металлических проводах, а протонов в водном растворе [9]. Впрочем, существуют и другие белки, способные преобразовывать энергию электронов, бегущих по белкам дыхательной цепи, в протонное электричество, которое накапливается в виде разности потенциалов на клеточных мембранах. Генераторы протонного электричества могут работать не только на топливе, т.е. на энергии окисления органических молекул, но и от света. Так происходит, например, в молекуле бактериородопсина и в фотосинтетических центрах хлоропластов высших растений. Достижения науки в этой области, основанные на расшифровке атомной структуры биомолекул, поистине грандиозны и многообещающи. Если есть все элементы для построения молекулярного робота, то почему бы не начать его создавать? Но это - тема отдельного разговора.
* * *
Рентгеноструктурный анализ белковых кристаллов - основной метод изучения пространственной структуры белковых молекул. В сочетании с другими биофизическими методами, в первую очередь с ядерным магнитным резонансом высокого разрешения и компьютерным расчетом укладки полипептидных цепей, белковая кристаллография позволяет раскрыть и объяснить механизм узнавания белками субстратов, ингибиторов, регуляторов, гормонов и лекарств; пути ферментативного катализа, процессов переноса электронов; молекулярные механизмы преобразования энергии в живых клетках и многое другое. Знания о расположении атомов и работе активных центров лежат в основе всей современной молекулярной биологии и протеомики, служат путеводной нитью в белковой и генной инженерии. Конструирование новых лекарств на основе драг-дизайна уже стало практикой в работе фармацевтических фирм. Будущее компьютерных технологий многие связывают с созданием базовых элементов компьютера, ячеек памяти и управляемых триггеров, с использованием белковых молекул, структуру которых можно усовершенствовать методами молекулярной биологии под контролем данных рентгеноструктурного анализа белков. Мировая наука вкладывает большие средства в развитие белковой кристаллографии, поскольку дифрактометры и высокопроизводительные расчетные, графические и синхротронные станции стоят недешево, как и работы по выделению, очистке и кристаллизации белков. Академия наук нашла возможность поддержать такие работы. Затраты эти безусловно окупятся, если мы этого захотим.
Литература
1. Куранова И.П. // Кристаллография. 2001. Т.46. №4. С.667-686.
2. Вайнштейн Б.К. // Наука и жизнь. 1986. №8. С.37-45.
3. Вайнштейн Б.К. // Наука и человечество. 1986. С.153-173.
4. Blundell T.L., Jhoti H., Abell C. // Nature reviews. 2002. №1. С.45-54.
5. Мелик-Адамян В.Р., Арутюнян Э.Г., Поляков К.М. Пространственная структура белков // Природа. 1997. №7. С.61-69.
6. Владимиров Ю.А., Конев С.В. // Биофизика. 1957. Т.2. №1. С.3-19.
7. Владимиров Ю.А., Тимофеев К.Н. // Биофизика. 1966. Т.11. №1. С.33-40.
8. Yankovskaya V. et al.// Science. 2003. V.299. P.700-704.
9. Тихонов А.Н. // Сорос. образоват. журн. 1997. Т.7. №20. С.10-17.