№10, 2006 г.
© Коренберг Э.И.
Происхождение возбудителей
природноочаговых болезнейЭ.И. Коренберг
Эдуард Исаевич Коренберг, доктор биологических наук,
рук. отд. природноочаговых инфекций и лаб. переносчиков инфекций
ГУ НИИ эпидемиологии и микробиологии им. Н.Ф.Гамалеи РАМН,
руководитель Центра по боррелиозам Минздрава России.Еще в незапамятные времена дикие животные были заподозрены в причастности к вспышкам эпидемий некоторых смертельно опасных для человека болезней. Научное подтверждение тому было получено лишь в XIX в., когда накопилось достаточно много свидетельств связи возбудителей этих заболеваний с членистоногими и позвоночными животными.
Так, американский исследователь Дж.Нотт выяснил, что в распространении малярии и желтой лихорадки повинны комары (причем еще задолго до открытия вируса, вызывающего желтую лихорадку).
Англичане И.Банкрофт и П.Мансон одновременно пришли к выводу, что определенные этапы развития некоторых филярий (паразитических нематод, вызывающих филяриидозы и, в частности, «слоновую болезнь») проходят в организме комаров.
Т.Смитт и Ф.Килборн в США установили, что пироплазмы (простейшие, паразитирующие в клетках крови позвоночных животных, иногда и человека) переносятся иксодовыми клещами, а британский военный врач Д.Брус и его супруга открыли значение кровососущих мух в передаче трипаносом - возбудителей так называемой сонной болезни.
Подтвердившееся впоследствии предположение, что лейшмании (внутриклеточные паразиты млекопитающих) передаются москитами рода Phlebotomus, высказали французские исследователи братья Сержан. Их знаменитый соотечественник Ш.Николь выяснил, что клещи-орнитодорины переносят спирохеты, вызывающие возвратный тиф (современное название - аргасовый клещевой боррелиоз). Х.Т.Риккетс в США заложил основы современных представлений о роли членистоногих в циркуляции риккетсий - возбудителей тяжелых заболеваний человека и животных (пятнистой лихорадки Скалистых гор, клещевого сыпного тифа и др.).
В 1897-1899 гг. почти одновременно французские (А.Йерсен, Э.Ру и П.Симонд), японский (М.Огата) и русский (Н.Ф.Гамалея) микробиологи связали возникновение чумных эпидемий и распространение этого заболевания с крысами и живущими на них блохами. В 1912 г. в астраханских степях И.А.Деминский выделил культуру возбудителя чумы от суслика. Годом раньше Д.К.Заболотный сделал это в Маньчжурии при исследовании больного монгольского сурка.
Безусловно, эти и многие другие открытия, доказывавшие, что дикие животные могут быть хранителями и переносчиками болезнетворных (патогенных) для человека микроорганизмов, вошли в «золотой фонд» мировой медико-биологической науки, однако все они представляли собой лишь разрозненные факты. Даже оформившаяся в те времена так называемая трансмиссивная теория (от лат. transmissio - передача) не объясняла истинной природы этих инфекций, что препятствовало эффективной борьбе с ними. Лишь в 1939 г. Е.Н.Павловский впервые сформулировал основные положения теории природной очаговости болезней, которая стала одним из значительных общебиологических обобщений, стимулировавших развитие ряда направлений в паразитологии, биоценологии, эпидемиологии, ветеринарии, медицинской географии и других науках.

Доноры, переносчики и реципиенты возбудителей туляремии [2].
Фундаментальная сущность этой парадигмы состоит в том, что возбудители многих болезней, как и любые другие биологические виды, возникли независимо от человека и существуют в природе как естественные сочлены экосистем [1]. Основной средой обитания и хозяевами для одних микроорганизмов служат различные, главным образом наземные, животные, другие же живут преимущественно в абиотической среде, их хозяевами могут быть водные беспозвоночные и даже, видимо, растения [3]. И те, и другие микроорганизмы способны вызывать заболевания человека, которые принято называть, соответственно, зоонозами и сапронозами. Разумеется, есть и переходные формы, но лишь при антропонозах резервуаром возбудителя, его главной средой обитания и специфическим хозяином служит человек. Для подавляющего же большинства возбудителей природноочаговых зоонозов и сапронозов он - случайный хозяин и биологический тупик, ни в коей мере не определяющий возможность их существования в естественных экосистемах. Возбудитель природноочаговых инфекций (за редкими исключениями) не передается от человека к человеку, и в этом главное отличие эпидемиологии таких инфекций от антропонозов. Каждое заболевание - результат ненужной для возбудителя встречи с конкретным человеком, который проник в экосистему, где обитает возбудитель [1].
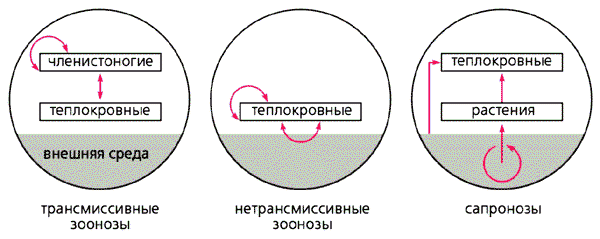
Принципиальные схемы циркуляции возбудителей болезней человека в природных очагах [4].
Стрелками отмечены пути передачи возбудителя.
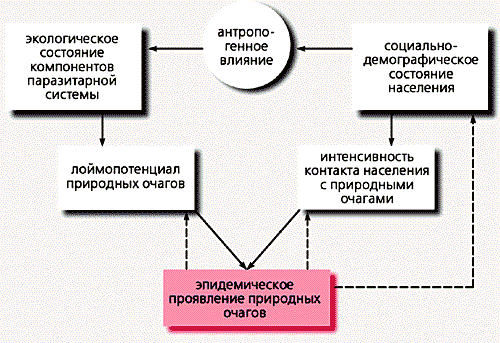
Схема взаимодействия основных природных и социальных факторов,
определяющих интенсивность эпидемического проявления природных очагов [5].
Стрелками обозначены направления воздействия,
пунктирными линиями - возможное при некоторых инфекциях воздействие.Уровень эпидемического проявления любого природного очага определяется, с одной стороны, интенсивностью циркуляции возбудителя, с другой - частотой контакта населения с этой потенциально опасной экосистемой. Природные очаги различных инфекций веками существовали в отсутствие людей или по соседству с их поселениями; они и сейчас распространены независимо от человека на безлюдных или мало населенных территориях. Вместе с тем люди, оказывая то или иное воздействие на экосистемы, изменяют условия существования возбудителей и таким образом воздействуют на интенсивность их циркуляции.
Все сказанное хорошо изучено и не вызывает сомнения, однако неясно, зачем и каким образом у микроорганизмов, обитающих в естественных экосистемах, для которых человек - совершенно случайный хозяин и биологический тупик, возникла патогенность, делающая их возбудителями болезней?
Патогенность
По общепринятым представлениям, патогенность - это некоторая совокупность генетически закрепленных видовых свойств микроорганизма, характеризующих его способность вызывать инфекционный процесс, а вирулентность (степень патогенности) и токсигенность - фенотипическое выражение патогенного генотипа, проявляющиеся, например, в особенностях определенного штамма.
Патогенные свойства могут проявлять не только паразиты, но и иные организмы - от мутуалистов (симбионтов, существующих на основе взаимовыгодного партнерства) до сапротрофов. Тем не менее обычно патогенность микроорганизмов связывают с их длительными взаимоотношениями с хозяевами: полагают, что в процессе коэволюции сапротрофы перешли к паразитизму, при этом под влиянием организма хозяина они утратили способность образовывать ставшие ненужными ферменты и приобрели способность синтезировать токсины и биополимеры, наделившие их патогенными свойствами. Вирулентность в этом случае рассматривают как функцию степени адаптации микроба к организму хозяина: высокая патогенность паразита свидетельствует о недавних, еще не вполне установившихся и несовершенных отношениях между паразитом и хозяином, а слабая, наоборот, - результат длительной коадаптации и, в конечном счете, коэволюции. По этой логике, степная пеструшка (Lagurus lagurus), например, столь восприимчива к некоторым не распространенным в открытых ландшафтах возбудителям потому, что никогда не сталкивалась с ними (ее даже используют в качестве модели для инфектологических экспериментов). Но почему тогда в аналогичной ситуации эти свойства не проявляют многие другие животные?
Такая бытующая по сей день логика если в какой-то мере и справедлива, то только для эволюционно сложившихся антропонозов (например, для ряда кишечных или воздушно-капельных инфекций), но ни в коей мере не в отношении большинства природноочаговых зоонозов, поскольку само существование их возбудителей не связано с длительной коэволюцией и коадаптацией с человеком, причем это относится ко всем группам микроорганизмов - от вирусов до простейших и гельминтов. Происхождение возбудителей вирусных и бактериальных болезней от симбионтных форм в целом обычно не вызывает сомнений. Однако и биологический смысл патогенности для человека возбудителей природноочаговых зоонозов, и механизмы ее возникновения остаются неясными: этот генетически детерминированный признак не имеет эволюционного значения, поскольку человек, напомню, - их случайный хозяин и «биологический тупик».
До недавнего времени по понятным причинам основное внимание уделялось исследованиям микроорганизмов, вызывающих заболевания человека. В значительной мере на эту задачу были ориентированы методы их выделения, идентификации и последующего изучения. Лишь в последнее десятилетие, когда стали широко использоваться молекулярно-генетические методы (ДНК-ДНК гибридизация, ПЦР и секвенирование генома), произошло лавинообразное накопление принципиально важных данных о разнообразии микроорганизмов. Стало очевидно, что патогенные для человека вирусы, риккетсии, бактерии, простейшие - это лишь часть, причем не всегда бoльшая, существующих в природе микроорганизмов той таксономической группы, к которой они принадлежат (таблица). Почему же одни микроорганизмы приобретают признаки патогенности для человека и способность быть этиологическими агентами заболеваний, а другие, близкие к ним, остаются свободноживущими сапротрофами или симбионтами позвоночных животных и (или) членистоногих?
Соотношение общего числа и патогенных для человека форм
в различных группах микроорганизмов
(по литературным сведениям и данным GenBank)
Патогенность и преадаптации
Для существующих в природе возбудителей природноочаговых инфекций организм человека - новая среда обитания. Освоить ее могут только те микроорганизмы, у которых еще в прежней среде обитания (т.е. преадаптивно) как побочный результат эволюционных изменений возникли свойства, позволяющие им выжить в новых условиях. В этом смысле возбудители природноочаговых инфекций не уникальны; значение преадаптаций в эволюционных процессах широко обсуждается с общебиологических позиций уже около века. Хорошо известно, что преадаптивные признаки появляются как побочный результат естественного отбора и имеют потенциальную селективную ценность при изменении внешних условий, в частности позволяют виду занять новую экологическую нишу.
Существует множество примеров, свидетельствующих, что микроорганизмы (вирусы, риккетсии, бактерии и др.) способны размножаться в организме некоторых позвоночных и членистоногих, причем эти микроорганизмы и их хозяева в естественных условиях никогда вместе не встречаются. К примеру, боррелии (возбудитель болезни Лайма) и вирус клещевого энцефалита столь хорошо размножаются в монгольской песчанке (Meriones unguiculatus), с которой в природе они никогда не сталкиваются, что этого степного грызуна предложено использовать для экспериментальной работы в качестве модельного лабораторного животного. Аналогичная по смыслу ситуация со степной пеструшкой уже упоминалась. Вирус классического клещевого энцефалита, отсутствующий в Новом Свете, прекрасно размножается в американских клещах Dermacentor anderson. Кошарного клеща (Alveonasus lahorensis) экспериментаторы прозвали «консервной банкой», поскольку в нем, как впрочем, и во всех аргасовых клещах, способны жить нехарактерные для них микроорганизмы. Известны и другие примеры реализации запрограммированных в геноме, но до поры до времени «спящих» возможностей (преадаптаций), возникших до встречи видов, которая приводит к становлению их паразито-хозяинных отношений.
Возбудителям зоонозов свойственна полипатогенность, а многим из них и политропность. Преадаптивно у них, прежде всего, должна была возникнуть способность размножаться в разных тканях и противостоять защитным (клеточным и гуморальным) механизмам хозяина.

Дендрограмма представителей рода Borrelia, построенная В.В.Нефедовой
на основании сходства нуклеотидных последовательностей 16S rРНК гена.
Цветом отмечены геновиды боррелий, для которых достоверно доказана патогенность для человека.Еще в 1969 г. К.Эндрюс обратил внимание на то, что некоторые арбовирусы, например, могут размножаться в пищеварительном тракте комнатных мух, саранчи, постельных клопов, жуков и бабочек. Такая способность, скорее всего, возникла преадаптивно. Однако внутриклеточные и тканевые паразиты, как правило, не могут длительно существовать в полости средней кишки многих насекомых и клещей. Чтобы оказаться в организме позвоночного животного (т.е. чтобы произошла передача возбудителя по схеме переносчик - резервуарный хозяин - переносчик) микроорганизмы, передающиеся трансмиссивным путем, должны попасть в слюнные железы кровососущих членистоногих, а до того, преодолев кишечный барьер, вызывать у них генерализованную (системную) инфекцию. Эти процессы вполне могут формироваться разными путями: не только преадаптивным, но и селективным уже после встречи микроорганизма с переносчиком в процессе их коадаптации.
В любой природной популяции одновременно происходит множество селективных процессов, однако их нельзя рассматривать как самостоятельные, независимые события, поскольку отбор действует на организм в целом, а не на его отдельный признак. Так как факторы отбора могли быть весьма разнообразными, патогенные для человека свойства микроорганизмов, по-видимому, возникли в разных их группах или даже у разных видов не направленно. Каждая группа патогенных микроорганизмов обладает характерной для нее совокупностью признаков, включая вид паразитизма (молекулярный, внутриклеточный, внеклеточный), локализацию размножения (ядро, цитоплазма, вне клеток), способ репликации (хемотрансформация, двойное деление, жизненный цикл) и важнейшие физико-химические свойства (фильтруемость, наличие клеточной стенки, рост на искусственной среде). Патогенные (вирулентные и токсигенные) признаки микроорганизмов контролируются генами хромосомальной или плазмидной ДНК. Однако функции очень многих бактериальных генов до сих пор неясны [6]. Возможно, они не только обслуживают различные состояния и процессы существования микробов в естественных условиях, но и представляют собой резерв для возможного проявления различных преадаптивных признаков, включая патогенность.
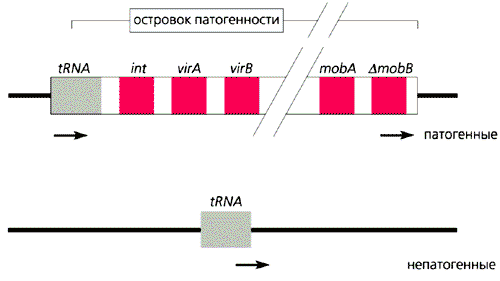
Модель бактериального островка патогенности [7].
Тонкая сплошная линия - участки основного генома с расположением специфических последовательностей, стрелки - прямые повторы на концах островка патогенности, прямоугольники - гены интегразы (int), вирулентности (vir), мобильности (mob) и пcевдомобильности (D mob). Образование островка патогенности - один из возможных путей возникновения возбудителей природноочаговых зоонозов.При изменении окружающих условий преадаптивные геномные перестройки могут быть обусловлены не только или даже не столько случайными точковыми мутациями, сколько горизонтальным переносом генов мобильными генетическими элементами. В структуре генома, бактериальных плазмид и фагов обнаружены, например, так называемые островки патогенности, которые, отличаясь нестабильностью, присутствуют в геномах патогенных штаммов и отсутствуют или редко встречаются в геномах непатогенных представителей тех же или родственных видов. Предполагается, что генетическая информация свободноживущих прокариотических организмов может быть источником многих генетических структурных элементов, которые прежде отсутствовали у непатогенных микробов. Новые варианты патогенов теоретически могут возникнуть при успешном переносе и закреплении в геноме нового элемента, например островков патогенности или плазмид. В дальнейшем вступают в действие механизмы взаимной адаптации патогена и его естественного хозяина. Все это вполне согласуется с концепцией случайного паразитизма возбудителей природноочаговых сапронозов, которые обладают рядом преадаптивных свойств [4, 8], и с представлениями об универсальности основных факторов патогенности, обеспечивающих существование микроорганизмов в разных средах обитания [4, 9, 10].Сапронозные корни гриппа
Напомню, хозяевами и природными резервуарами возбудителей сапронозов могут быть простейшие (амебы, инфузории и др.) и прочие обитатели почвы и гидробионты. Адаптивное формирование биологических особенностей этих микроорганизмов направлено прежде всего на обеспечение их существования в естественной среде обитания, т.е. в почвенных или водных экосистемах. Между патогенными и потенциально патогенными бактериями и другими сочленами этих экосистем могут формироваться разные варианты симбиотических отношений, включая паразитизм. В результате таких биоценотических процессов на популяционном уровне преадаптивно соотбираются (и во многих случаях закрепляются как видовые) генетически детерминированные признаки и свойства, позволяющие микроорганизмам существовать также в организме теплокровных животных [3, 4, 11].
Весьма вероятно, что вирусы гриппа вообще и так называемого «птичьего гриппа», в частности, исходно имеют именно сапронозное происхождение. По сути дела их природноочаговые «корни», проявляющиеся в связи вирусов с дикими птицами, теперь уже ни у кого не вызывают сомнений. Но действительно ли птицы - основные резервуарные хозяева вирусов, обеспечивающие долговременное существование их природных очагов, как это сейчас принято считать и хорошо известно для некоторых арбовирусов (например, возбудителя лихорадки Западного Нила), передающихся комарами, т.е. трансмиссивным путем? Не вовлекаются ли сами пернатые в первичную эпизоотическую цепочку циркуляции вирусов гриппа, которая изначально может реализовываться в водных экосистемах без их участия? В пользу этой гипотезы говорят разнообразные факты, опубликованные в последнее время [12], в том числе и в журнале «Природа» [13]. Приведу в определенной последовательности главные из них:
Итак, вирусы гриппа в естественных условиях изначально соответствуют признакам возбудителей водных сапронозов. По всей видимости, их связывают симбиотические отношения с гидробионтами. Именно эти отношения приводят к генотипическим изменениям вирусной популяции, основной биологический смысл которых состоит в обеспечении его длительного существования в естественных водных экосистемах. В результате этого процесса преадаптивно возникают антигенные варианты вируса, к которым восприимчивы околоводные и другие птицы, причем некоторые из них патогенны для диких и домашних млекопитающих, в том числе и человека.
- вирусы гриппа А способны длительно сохраняться во внешней среде (в воде до месяца при 22°С и до 6-8 мес. - при +4°С);
- в естественных условиях вирусы гриппа способны к антигенному дрейфу - постепенным мутационным процессам, которые приводят к изменениям структуры поверхностных антигенов (гемагглютинина и нейроаминидазы), играющих в значительной мере роль факторов патогенности;
- все известные подтипы вирусов гриппа А обнаружены у птиц (в основном у водоплавающих и околоводных); среди вирусов гриппа диких птиц могут быть патогенные для домашних птиц (вызывающие их гибель), различных млекопитающих, в том числе и человека (например вирус H9N2 или всем известный в последнее время вирус H5N1);
- у водоплавающих птиц инфекция обычно протекает бессимптомно; вирус размножается в основном в клетках кишечника и выделяется с фекалиями, а это значит, что грипп у птиц - типичная инфекция кишечной группы, для которых не характерна непосредственная прямая передача возбудителя от инфицированной особи здоровой (например, воздушно-капельным путем), но типично заражение алиментарным путем через воду и (или) пищу; по всей видимости, именно алиментарным путем заражаются домашние птицы и млекопитающие, а также ластоногие и китообразные;
- млекопитающие (особенно свиньи) восприимчивы как к вирусам гриппа птиц, так и человека; одновременная репликация вирусов в организме этих хозяев приводит к реассортации возбудителей, при которой возможна полная замена фрагментов генома и появление вируса нового или давно отсутствовавшего типа, включая патогенные для человека, способные передаваться воздушно-капельным путем от больных людей здоровым;
- пандемии гриппа обычно начинаются в теплых регионах Юго-Восточной Азии (в частности, в Китае), при этом их возбудители - новые для людей или давно не встречавшиеся подтипы вирусов.
Время от времени такие клоны появляются в вирусной популяции особенно часто, что связано с колебаниями численности (свойственными и прокариотическим, и эукариотическим организмам), которые С.С.Четвериков называл, как известно, «волнами жизни», а Н.В.Тимофеев-Ресовский - «популяционными волнами». Это приводит к увеличению вероятности алиментарного заражения птиц, которые, в свою очередь, выделяя вирус с экскрементами, способствуют его интенсивному распространению в водных экосистемах (включая небольшие водоемы), находящихся рядом с жилищами человека. Во многих хозяйствах утки и гуси содержатся в непосредственной близости с курами, свиньями и другими домашними животными в неудовлетворительных санитарно-гигиенических условиях. Это способствует реализации фекально-орального пути передачи возбудителя, причем в эпизоотию особенно быстро вовлекаются домашние птицы и свиньи. Так возникают антропургические (т.е. в преобразованной человеком среде) или скорее даже синантропические очаги гриппа.
Наиболее подходящие для этого условия (абиотические, биотические и социальные) складываются в Юго-Восточной Азии. Именно там периодически возникают эпизоотии среди домашних птиц и первые случаи заболевания людей гриппом. Инфицирование домашних уток [14] (и, видимо, кур) вирусом H5N1, например, происходит не на крупных птицеводческих фабриках, где соблюдаются санитарно-гигиенические правила, а в индивидуальных хозяйствах, где могут заражаться домашние кошки и даже голуби [15].
В начале каждого такого цикла по отношению к людям грипп проявляется как типичная природноочаговая сапронозная инфекция (рис. 2, 3): вирус не передается от человека к человеку, и все сравнительно немногочисленные случаи заболеваний возникают в результате индивидуального контакта людей с источником возбудителя (с водой или продуктами питания). Параллельно в антропургических очагах в результате реассортации вирусов (главным образом на свиньях) могут возникнуть патогенные варианты вируса, способные передаваться от человека к человеку воздушно-капельным путем. С этого момента эпидемии, периодически перерастающие в пандемии, развиваются по схеме классических антропонозных инфекций, что детально описано и хорошо известно.
* * *
Недоказанной остается лишь гипотеза о существовании вирусов гриппа в водных экосистемах, об их симбионтных отношениях с гидробионтами и изначально преадаптивном возникновении антигенных вариантов вируса, к которым восприимчивы птицы и млекопитающие. Она нуждается в экспериментальных и прямых доказательствах, которые могут быть получены вирусологами в комплексе со специалистами по экологии гидробионтов.
Если гипотеза подтвердится, это будет означать, что главным объектом мониторинга должны стать водные экосистемы, в которых возникают варианты генотипа вируса гриппа, представляющие потенциальную опасность для распространения среди птиц и млекопитающих и дальнейших шифтовых изменений, способных осложнить эпидемическую ситуацию. Однако уже сейчас очевидно, что профилактика этих осложнений должна быть прежде всего основана на разработке и широком применении мер, препятствующих реассортации вирусов гриппа, в процессе которой могут появляться его варианты, передающиеся от человека к человеку.
Работа выполнена при поддержке Российского фонда фундаментальных исследований.
Проект №04-04-48046.Литература
1. Коренберг Э.И. Что такое природный очаг. М., 1983.
2. Олсуфьев Н.Г. // Вопросы краевой, общей и экспериментальной паразитологии и медицинской зоологии. Т.VIII. М., 1953. С.49.
3. Литвин В.Ю., Коренберг Э.И. // Паразитология. 1999. Т.32. №3. С.179.
4. Литвин В.Ю., Гинцбург А.Л., Пушкарева В.И. и др. Эпидемиологические аспекты экологии бактерий.
М., 1998.
5. Коренберг Э.И., Юркова Е.В. // Медицинская паразитология и паразитарные болезни. 1983. №3. С.3.
6. Дебабов В.Г. // Молекулярная биология. 1999. Т.33. №6. С.1074.
7. Hacker J., Кареr J. // Ann. Rev. Microbiol. 2000. V.54. P.641.
8. Сомов Г.П., Литвин В.Ю. Сапрофитизм и паразитизм патогенных бактерий. Новосибирск, 1998.
9. Бухарин О.В., Литвин В.Ю. Патогенные бактерии в природных экосистемах. Екатеринбург, 1997.
10. Доморадский И.В. // Журнал микробиологии, эпидемиологии и иммунобиологии. 1993. №1. С.103.
11. Пушкарева В.И. // Успехи современной биологии. 2006. Т.126. №4. С.323-333.
12. Деева Э.Г., Еропкин М.Ю., Григорьева В.А. и др. // Журнал микробиологии, эпидемиологии
и иммунобиологии. 2006. №1. С.81.
13. Львов Д.К., Забережный А.Д., Алипер Т.И. Вирусы гриппа: события и прогнозы // Природа. 2006.
№6. С. 3-13.
14. Songserm Th., Jam-on R., Sae-Heang N. et al. // Emerging Infectious Diseases. 2006. V.12. №4. P.575.
15. Songserm Th., Amonsin A., Jam-on R. et al. // Emerging Infectious Diseases. 2006. V.12. №4. P.681.