№9, 2003 г.
№9, 2003 г.
© В.А. ОтеллинФормирование патологий головного мозга
в эмбриональный периодВ.А. Отеллин
Владимир Александрович Отеллин, член-корреспондент РАМН, профессор,
руководитель отдела морфологии Института экспериментальной медицины РАМН,
заведующий лабораторией онтогенеза нервной системы Института физиологии им.И.П.Павлова РАН.С 90-х годов минувшего века, объявленных ООН Десятилетием изучения головного мозга, возросло число фундаментальных и прикладных исследований, затрагивающих все уровни организации мозга - от клеточного до системного и организменного. Особое внимание медики и биологи уделяют проблемам формирования центральной нервной системы человека в эмбриональный период, когда закладываются основные структурные и функциональные характеристики, присущие зрелому мозгу. В это же время возможны и разнообразные сбои в реализации генетической программы развития организма, которые сказываются на формировании плода, а после рождения могут проявиться многочисленными уродствами и нервно-психическими заболеваниями. Инициация и развитие этих процессов нередко обусловлены наследственной (хромосомной и генной) патологией, но иногда связаны с неблагоприятным воздействием внешних и внутренних факторов (загрязнением окружающей среды, повышением радиационного фона, психологическими перегрузками и стрессами, вредными привычками родителей и т. д.).
По данным неонатологов, с конца 90-х годов наблюдается постоянный рост количества неврологических нарушений у детей разных возрастных групп, причем в 27-44% случаев нервно-психические расстройства обусловлены нарушениями внутриутробного развития [1]. Очевидно, что научный поиск причин возникновения этих отклонений должен быть направлен на изучение клеточных и тканевых особенностей нервной системы эмбрионов, плодов и новорожденных детей. При этом важно понять роль внутриутробных структурных изменений нервной системы в дальнейшем нервно-психическом развитии ребенка.
В последние годы заметно возросло число экспериментальных работ, посвященных изучению влияния неблагоприятных факторов (радиации, алкоголя, никотина, наркотиков и т. д.) на те или иные функции головного мозга животных. В результате установлены различия в проявлениях дозозависимых эффектов в структурах и функциях головного мозга на разных сроках эмбрионального развития. Однако регистрируемые отклонения никак не соотносились с клеточными и тканевыми процессами, характерными для каждой эмбриональной структуры мозга в строго определенные сроки внутриутробного развития - так называемые критические периоды.
В понятии «критический период» нет ничего трагического; это этап нормального развития зачатков органов, когда они особенно чувствительны к действию как биологически активных веществ, запускающих и регулирующих клеточные и тканевые процессы генетической программы развития, так и неблагоприятных факторов среды, искажающих эту программу и приводящих к формированию патологии. В пренатальный период (т. е. до рождения) каждый зачаток проходит один или несколько таких этапов, биологический смысл которых состоит в том, что создается материальный фундамент, определяется следующий этап развития. Роль высокой чувствительности эмбрионов во время критических периодов заключается в повышении восприимчивости организма к действию факторов, обеспечивающих реализацию наследственных потенций.
Значение критических периодов в индивидуальном развитии организмов экспериментально подтвердил выдающийся отечественный эмбриолог П.Г. Светлов, получивший в 1960 г. за свою фундаментальную разработку Государственную премию СССР. Светлов, назвавший онтогенез реактивным процессом, подробно изучил на грызунах два критических периода: первый, предшествующий прикреплению (имплантации) зародыша к стенке матки, когда отмечена наиболее частая гибель зародышей после разнообразных воздействий, и второй (имплантационный), когда формируются зачатки органов и когда неблагоприятные факторы могут способствовать возникновению различных пороков [2]. Эти основные выводы обобщил ученик П.Г. Светлова - В.Ф. Пучков (рис. 1). Понятно, что гибель эмбрионов, пороки их развития и уродства вызваны нарушением процессов формирования тканей и органов, однако хотелось бы знать конкретные механизмы возникновения патологий, поскольку без этого нельзя разработать способы коррекции и профилактики врожденных дефектов.
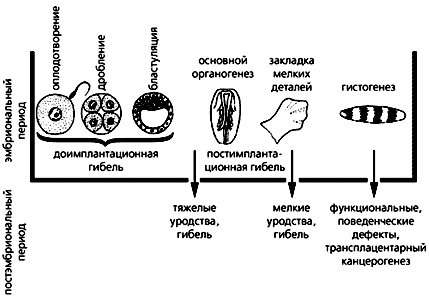
Рис.1. Действие повреждающих факторов в критические периоды эмбриогенеза
и вызванные этим последствия. (По В.Ф. Пучкову.)По наблюдениям клиницистов, отклонения в развитии нервной системы наиболее часто связаны с перенесенной в пренатальный период гипоксией (недостатком кислорода), вызванной патологическим состоянием беременной женщины или плода, загрязнением окружающей среды и т. д. [3]. Гипоксические повреждения эмбрионального мозга после рождения могут способствовать развитию эпилепсии и церебрального паралича, стать дополнительным фактором риска психических и нейродегенеративных заболеваний, вести к нарушению поведенческих реакций, а в особо тяжелых случаях - к гибели детей [4].
К сожалению, большинство названных заболеваний и расстройств не поддается эффективному лечению, что в первую очередь связано с отсутствием четких представлений о механизмах и последовательности процессов (патогенезе), приводящих к развитию конкретной формы болезни. Без знания того, что, как и каким образом изменяется в головном мозге под влиянием болезнетворных факторов, невозможно разработать стратегию лечения, направленного на коррекцию нарушенных процессов, а не их последствий. Лечение, как требует современная медицина, должно быть патогенетическим. Другими словами, нужно воздействовать на причины, вызывающие развитие болезни, а не только на последствия патологических процессов. Именно поэтому необходимо экспериментально изучать формирование структур головного мозга на фоне воздействия неблагоприятных факторов среды в эмбриональный период, установить характеристики, глубину изменений разных отделов мозга в разные фазы развития, что до сих пор практически не исследовано. Получение таких данных составит основу для разработки новых, патогенетически обоснованных методов диагностики, лечения и профилактики врожденных заболеваний центральной нервной системы.
В наших экспериментах, в которых участвовали сотрудники отдела морфологии Института экспериментальной медицины РАМН, лаборатории онтогенеза нервной системы Института физиологии им. И.П. Павлова РАН и Института эволюционной биохимии и физиологии им. И.М. Сеченова РАН, мы не ограничивались анатомическим, макроскопическим уровнем. Изучая эмбриональное развитие головного мозга млекопитающих (в том числе и человека) при нормальном протекании беременности и на фоне воздействий неблагоприятных факторов, мы использовали современные морфологические (световую и электронную микроскопию, иммуноцитохимию, нейротрансплантацию, компьютерную морфометрию, поведенческие физиологические методы) и физиологические методы исследования, позволяющие оценивать способность к обучению и состояние мотивационно-эмоциональной сферы.
Нам предстояло решить несколько задач.
Во-первых, необходимо было изучить реакции функционально различных формаций головного мозга родившихся крыс (новой и старой коры мозга, базальных структур, стволовых ядер - основных поставщиков моноаминов мозга) на однократные гипоксические воздействия в течение пренатального периода.
Во-вторых, - определить зависимость характера изменений в развивающейся нервной ткани от стадии, на которой эмбрионы подвергались гипоксии.
Кора больших полушарий головного мозга была выбрана в качестве объекта исследования далеко не случайно. Она отличается четкой упорядоченностью строения, а потому сравнительно легко поддается качественному и количественному анализу отклонений в развитии. У человека эта часть головного мозга достигла наивысшего развития и принимает участие в регуляции и построении практически всех функций организма, включая память, познавательные и мыслительные процессы. Кора головного мозга подразделяется на эволюционно древние, старые (архикортекс) и новые (неокортекс) отделы, в которых выделяется около 100 цитоархитектонических полей и подполей. Каждый участок отличается характерным строением: своеобразным распределением и соотношением типов нервных клеток (больших, малых и средних пирамидных, звездчатых, веретенообразных, биполярных) в слоях (которых в поперечнике коры может быть до семи-восьми), различающихся по толщине, плотности и ориентации в них клеток. Все эти клетки взаимосвязаны друг с другом и с клетками других отделов мозга посредством систем ассоциативных, проекционных и комиссуральных путей. В пределах цитоархитектонических полей или функционально специализированных зон коры мозга нервные клетки объединяются в так называемые колонки (за их открытие в 1981 г. Р. Сперри, Д. Хьюбел и Т. Визел получили Нобелевскую премию), в которых обрабатываются приходящие и исходящие импульсы. В настоящее время есть все основания утверждать, что столь сложная и в определенной мере унифицированная конструкция коры головного мозга обеспечивает ее многочисленные функции.
Первые же результаты экспериментов оказались для нас неожиданными. Однократное часовое содержание крыс на разных сроках беременности (13-й и 16-й день) в среде с недостатком (7.5%) кислорода привело как к тяжелым нарушениям общего развития потомства, так и к существенным структурным изменениям в центральной нервной системе. Отмечалось уменьшение размеров и веса плодов, сокращение объема их мозга, расширение желудочков мозга. Действие острой гипоксии в эти периоды, когда в коре активно протекают базисные гистогенетические процессы (деление клеток, их перемещение и созревание), приводит к истончению и недоразвитию ее слоев, нарушению ориентации и темпов созревания (дифференцировки) нервных и глиальных клеток. В более поздний постимплантационный период (19-й день), когда уровень деления клеток в мозге снижается и ускоряются процессы их созревания, гипоксия оказывает менее выраженный повреждающий эффект. Во всяком случае, сформировавшиеся слои коры незначительно отличались от контрольных..
Микроскопический анализ показал, что у новорожденных, пяти- и шестидневных крысят, перенесших острую гипоксию на 13-й и 16-й дни эмбриогенеза, все слои коры истончены и имеют меньшее, чем в контроле, количество нейронов, в том числе больших пирамидных клеток, участвующих в тонкой координации двигательных актов. Кроме того, нервные клетки выглядят незрелыми и их ориентация часто нарушена.
Несколько иные изменения в неокортексе наблюдались у потомства крыс, перенесших воздействие гипоксии на 19-й день эмбрионального развития. Исследование мозга крыс на 10-й день после рождения показало, что обнаруженное в предыдущие сроки некоторое истончение верхних слоев коры к этому времени нивелируется. Правда, во всех слоях встречаются отдельные погибшие клетки (пять-шесть в поле зрения). Таким образом, воздействия повреждающих факторов в более поздние сроки постимплантационного периода оставляют в структурах мозга не аномалии и уродства, видимые невооруженным глазом, а микроскопические отклонения в общей компоновке и деталях строения коры головного мозга, недоразвитии нервных клеток, нарушении их взаимосвязей, которые могут проявиться в дальнейшей жизни животного.
В параллельно проводимых физиологических исследованиях было показано, что гипоксия на 16-е сутки эмбриогенеза приводит к изменению поведения крыс: самцы на открытом пространстве становятся активнее, выказывают тревогу, а самки, напротив, - пассивнее. Более того, у таких животных происходит инверсия полового поведения: самки начинают вести себя как интактные самцы, а самцы уподобляются самкам. Интересно, что недостаток кислорода на 19-е сутки внутриутробного развития вызвал у крыс обоего пола одинаковое изменение поведения на открытом пространстве - уровень тревожности и у самок, и у самцов снизился.
Сегодня мы очень мало знаем о механизмах, запускающих приспособительные и патологические реакции в ответ на воздействия повреждающих факторов. Понятно, что внешние раздражители (боль, температура, радиация, ядовитые вещества, недостаток кислорода и т.п.) опосредуют свои воздействия через разнообразные механизмы - рецепторные, молекулярные, что в итоге трансформируется в нервные процессы, организующие те или иные ответные реакции. Существенная роль в этом принадлежит серотонинергическим механизмам (синаптическим и несинаптическим), которые обеспечивают межклеточные взаимодействия с помощью серотонина - биологически активного моноамина, медиатора нервной системы и гормона. В эмбриональный период онтогенеза серотонинергические нейроны контролируют процессы развития нервной ткани и отделов мозга, а после рождения участвуют в регуляции мотивационно-эмоциональных компонентов поведения, процессов обучения и памяти, болевой чувствительности и т. д. Серотонинергической системе отводится важная роль и в формировании нервно-психических заболеваний и расстройств (шизофрении, маниакально-депрессивного психоза, состояния тревожности и депрессивности, мигрени), однако большинство механизмов и структурных проявлений этих нарушений до настоящего времени изучено недостаточно.
В сериях наших экспериментов со снижением концентрации серотонина в разные критические сроки внутриутробного развития нам удалось подтвердить выявленные П.Г. Светловым общие закономерности реакций эмбриональных тканей на воздействия повреждающих факторов. Блокада парахлорфенилаланином (ПХФА) ключевого фермента синтеза серотонина - триптофангидроксилазы - в доимплантационный период (до внедрения зародыша в стенку матки) часто приводит к торможению вплоть до полной остановки процессов развития зародышей. Нарушается процесс формирования структур, обеспечивающих питание их элементов, в том числе внутренней клеточной массы, дающей начало всем клеткам и тканям эмбрионов (рис.2).
Рис.2. Эмбрионы мыши на четвертый день развития: контроль (слева) - нормально развитый зародыш; опыт (справа) - зародыш с патологиями, вызванными введением ПХФА на второй день беременности самок. Видны полость (бластоцель) и очень крупные по сравнению с контролем клетки трофобласта (наружного клеточного слоя).Снижение уровня эндогенного серотонина на ранних постимплантационных стадиях активного органогенеза (когда меняется тип питания зародыша и формируется плацента) приводило к недоразвитию плодов, образованию мозговых и пупочных грыж, микроофтальмии, расщелинам твердого нёба (рис. 3). В результате микроскопического исследования были выявлены другие патологические изменения в центральной нервной системе плодов: обширные кровоизлияния в разных отделах мозга (в продолговатом мозге, полосатом теле и в сосудистых сплетениях желудочков).
Рис.3. Эмбрионы мыши (18-й день развития) после введения ПХФА
на восьмой день беременности самок.
Видны мозговые грыжи, подкожные кровоизлияния.Возникновение аномалий в течение ранних стадий постимплантационного эмбриогенеза может быть обусловлено обнаруженным нами уменьшением общего числа внутримозговых серотонинергических нейронов и их аксонов после блокады синтеза серотонина во время предшествующих фаз развития. В результате возможно возникновение вторичного дефицита эндогенного серотонина, который, как хорошо известно, тормозит деление (пролиферацию) и созревание (дифференцировку) нервных и глиальных клеток, обеспечивающих все функции головного мозга.
Оказалось, что в более поздние стадии развития зародышей, когда происходит активное формирование отделов мозга, снижение уровня эндогенного серотонина приводит к нарушению деления клеток, изменению числа и направлений их миграции к генетически обусловленным участкам развивающегося мозга, а также задерживается превращение клеток-предшественников (бластных форм) в зрелые нервные и глиальные клетки. В результате этого происходит в большей или меньшей мере выраженное недоразвитие одного или многих отделов мозга, формирование аномалий или патологических очагов.
Контроль (слева) - у животных, развивавшихся в обычных условиях, упорядочены слои и строго вертикально ориентированы отростки нейронов.
Опыт (справа) - у животных, развивавшихся на фоне введения ПХФА, происходит задержка созревания нервных клеток, увеличено их число на единицу площади, нарушена ориентация отростков нервных клеток.
После рождения, в период до и в самом начале полового созревания, у таких животных отмечены отклонения в мотивационно-эмоциональной сфере (снижался уровень тревожности), в способности к обучению (ухудшались выработка и воспроизведение условного рефлекса пассивного избегания). Причем, динамика этих изменений отличалась половым диморфизмом.
Таким образом, создается впечатление, что действие различных факторов (будь то гипоксия или дефицит серотонина, или еще что-то) в определенные критические периоды эмбриогенеза вызывают сходные нарушения в развитии мозга, приводящие к формированию абнормальных структур, изменению клеточного состава и, вероятно, межнейронных связей, что сочетается с отклонениями в мотивационно-эмоциональном поведении после рождения. Безусловно, многое еще неясно, и пока рано говорить о медикаментозной коррекции этих нарушений. Исследования необходимо продолжать. Тем не менее уже сейчас необходимо привлечь самое широкое внимание к профилактике трагических последствий пренебрежения здоровым образом жизни и своевременному лечению заболеваний беременных женщин, особенно в сроки от оплодотворения до завершения основного органогенеза у эмбрионов (шесть-восемь недель). Именно этот период наиболее опасен для жизни и здоровья потомства.
Литература
1. Володин Н.Н., Медведев М.И., Рогаткин С.О. // Журн. невропатологии и психиатрии им.С.С.Корсакова. 2001. Т.101. №7. С.4-8.
2. Светлов П.Г. Физиология (механика) развития. Л., 1978.
3. Neakas C., Buwalda B., Luiten P. // Progress in Neurobiology. 1996. V.49. №1. P.1-51.
4. Cannon T., Erg T.van, Rosso I. et al. // Arch. Gen. Psychiatry. 2002. V.59. №1. P.35-41.