No.8, 2007 г.
© Рубцов Н.Б.
Хромосома человека в четырех измерениях
Н.Б. Рубцов
Николай Борисович Рубцов, д.б.н., зав. лаб. морфологии и функции клеточных структур Ин-та цитологии и генетики СО РАН (Новосибирск)
В марте 2000 г. на весь мир громко и гордо прозвучало: "Геном человека секвенирован!". Однако скоро стало ясно, что геном человека прочитан, но не расшифрован. Сегодня приходится признать, что мы научились читать и писать, почти не понимая того, что пишем и читаем. Пока нам известны лишь некоторые "слова" и понятны некоторые правила этого нового языка, изучение которого, возможно, окажется более сложной задачей, чем простое "чтение-записывание" в длинные цепочки символов A, T, G, C. На этом пути нас явно ждут многочисленные проблемы. Одна из них состоит в том, что геном, записанный пока в одномерном варианте, на самом деле трех- или даже четырехмерен.
В настоящее время одно из важных направлений в изучении реального генома - расшифровка пространственной организации хромосом и их отдельных районов. Наши исследования хромосомных перестроек показали, что реорганизация даже одной отдельной хромосомы может изменить общую архитектонику ядра.
Хромосомы вчера и сегодня
История изучения хромосом интересна и поучительна. Обращаясь к ней, невольно вспоминаешь некоторые с детства знакомые мудрые изречения и притчи. Например, что искать что-либо лучше всего там, где светло. А история обследования слона группой слепых показывает, насколько наши представления об объекте зависят от того, до какой его части мы смогли дотянуться. Долгое время изучение хромосом млекопитающих в какой-то мере сильно напоминало этот процесс. В большинстве клеток хромосомы можно было увидеть лишь во время относительно короткого отрезка времени, связанного с делением клетки, т.е. во время митоза. Конечно, есть немало исключений. В некоторых клетках, у некоторых видов (почти как в некотором царстве, некотором государстве) нашли огромные хромосомы, видимые даже невооруженным глазом, причем во время интерфазы, когда в обычных клетках хромосома остается невидимой и активно работает. Эти исключительные хромосомы оказались конгломератом более 1000 копий исходной хромосомы. Самые известные примеры таких гигантов - политенные хромосомы Drosophila melanogaster и Chironomus tummy.
Хромосомы млекопитающих, в том числе и человека, намного меньше политенных. Однако трудность их анализа заключалась не в малом размере: для биологов, вооруженных электронным микроскопом, хромосома человека велика. Проблема в другом. В обычных клетках в интерфазе хромосомы так плотно прилегают друг к другу, что даже при самом бережном обращении их материал так перемешивается, что не остается никаких шансов рассмотреть отдельные хромосомы, не говоря уже о каких-либо деталях. Но несмотря на все эти трудности, цитогенетики с помощью электронной микроскопии немало сделали в изучении организации хромосомы и ее отдельных элементов. Надо отдать должное и политенным хромосомам, которые долго рассматривали как непревзойденную модель интерфазной хромосомы.
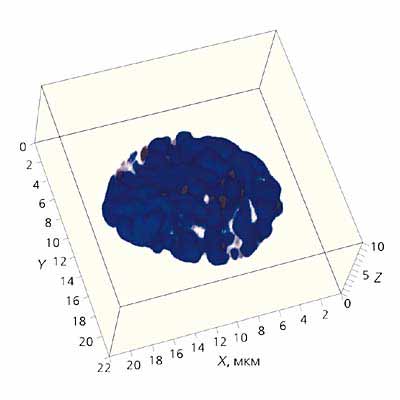
Рис. 1. Трехмерная реконструкция хромосом фибробласта бурозубки в митозе.
Синим цветом обозначена ДНК хромосом, темно-серым - теломерные районы; линиями - район сканирования.
Масштаб указан по осям X, Y и Z. Конфокальная микроскопия проведена на микроскопе LSM510META производства фирмы ZEISS.Вернемся к хромосомам человека. Они превращаются в прочные структуры лишь на короткое время, непосредственно перед делением. Именно на стадии митоза появляется шанс рассмотреть их достаточно подробно (рис.1). Правда, предварительно их надо отделить одну от другой и разложить на стекле. Эта задача долго оставалось непосильной. С момента первых описаний хромосом во второй половине XIX в. прошло около 80 лет, прежде чем цитогенетики смогли правильно подсчитать число хромосом у человека. Это сделали в 1956 г. практически одновременно две пары исследователей: Дж.Тио и А.Леван, Ч.Форд и Дж.Хаммертон. Их работы стали переломным моментом в изучении хромосом человека.
В конце 60-х - начале 70-х после разработки методов дифференциального окрашивания появилась возможность идентифицировать все хромосомы человека и их отдельные районы. Поскольку в таких исследованиях хромосомы выглядели как вытянутые структуры, состоящие из участков с различной интенсивностью окрашивания (их шириной и толщиной можно было пренебречь), для их описания достаточно было перечислить порядок и ориентацию всех участков (рис.2).

Рис. 2. GTG-окрашенные метафазные хромосомы человека (47, XY, +18).
Учитывая, что основу хромосомы составляет неимоверно длинная молекула ДНК, которая в свою очередь описывается как чередование пуриновых и пиримидиновых оснований (-ATGGTCACCTAGTTC-), мы привыкли воспринимать хромосому, с одной стороны, как отдельный элемент генома, с другой - как одномерную структуру. На этих представлениях строилась стратегия гибридизации для определения локализации конкретных генов сначала с точностью до хромосомы, а затем до ее района. Проводя картирование генов человека и других млекопитающих, мы, как и другие исследователи, работающие в этой области, следили, совместно с какой хромосомой, а затем и ее районом теряется интересующий нас ген [1].
Наши представления о хромосоме почти не изменились, даже когда появились методы локализации в хромосоме конкретных последовательностей ДНК с помощью гибридизации нуклеиновых кислот in situ (непосредственно на своем месте). Этот метод во многом способствовал прочтению генома человека. Но в результате дальнейших исследований стало ясно, что данных о последовательности нуклеотидов в ДНК явно недостаточно для реальной расшифровки генома человека. Усилиями молекулярных биологов и биоинформатиков получены некоторые представления о трехмерной организации генома, но эти успехи обычно ограничены сравнительно небольшими его участками. Попытки провести реконструкцию трехмерной организации всего генома человека в виртуальном компьютерном мире (in silico) дали пока весьма ограниченные результаты. Возможно, биоинформатики и смогут решить некоторые вопросы, но проверку найденных ими ответов все равно придется проводить экспериментаторам.
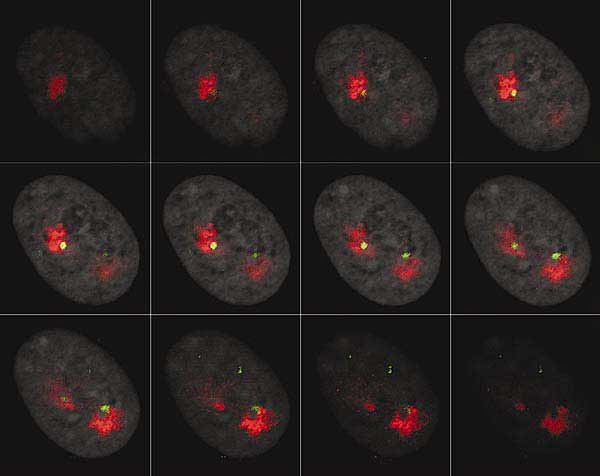
Рис. 3. Частичная галерея оптических срезов интерфазного ядра фибробласта человека.
Красным выделена ДНК хромосомы 9; зеленым - ДНК центромерного района хромосомы 9; серым - ДНК всех хромосом.Сегодня пришли новые технологии и методы, благодаря чему микроскопия в биологии стала трехмерной. Появилась возможность рассмотреть хромосому в интерфазном ядре и получить информацию о локализации в нем сразу всех хромосом человека [2]. Для этого широко применяют гибридизацию in situ (FISH) ДНК индивидуальных хромосом, меченной флуоресцентными красителями, с ДНК интерфазного ядра. Затем с помощью лазерного сканирующего микроскопа получают серию оптических срезов ядра, на которых зарегистрированы интересующие исследователя сигналы (рис.3). Такие оптические срезы можно рассматривать отдельно, использовать для создания ортогональных проекций (рис.4) или для реконструкции трехмерной организации клеточного ядра (рис.5).
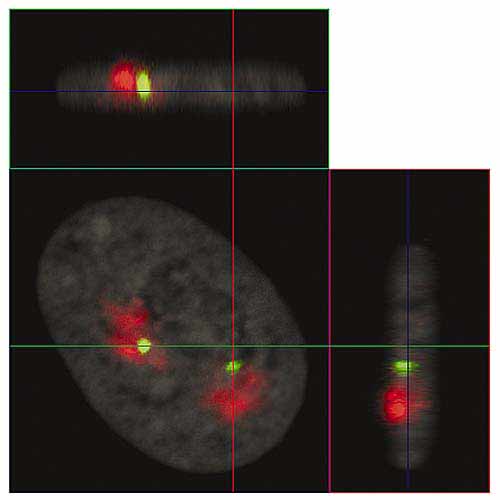
Рис. 4. Ортогональные проекции интерфазного ядра фибробласта человека (серии их оптических срезов приведены на рис.3).
Линии показывают положения плоскостей оптических срезов: XY - синяя, XZ - зеленая, YZ - красная.
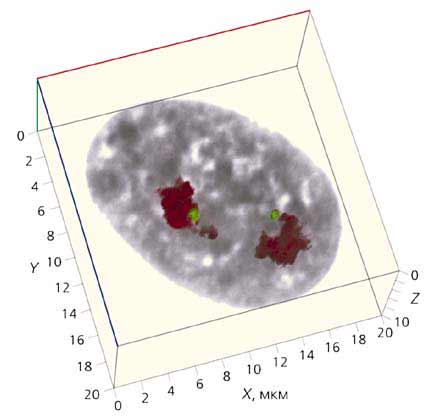
Рис. 5. Трехмерная реконструкция интерфазного ядра фибробласта человека
из серии оптических срезов, приведенных на рис.3.
Масштаб указан по осям X, Y, Z.Удивительно, как мало времени потребовалось, чтобы перейти к работе в четырехмерном пространстве. Еще одной координатой стало время. Результаты поиска в интернете по словам 4D-microscopy (3D time-lapse microscopy) демонстрируют наглядные доказательства прогресса в этом направлении. То, что совсем недавно казалось абсолютно невозможным, сегодня - передовой край исследований, а завтра превратится, вероятно, в рутину лабораторных будней. Стоит отметить, что разработанные нами методы микродиссекции метафазных хромосом для получения разнообразных ДНК-зондов внесли свой вклад в превращение молекулярной цитогенетики в эффективную систему диагностики хромосомных аномалий.
Происхождение прекрасных метафазных хромосом
Аккуратно разложенные на поверхности стекла прометафазные и метафазные хромосомы млекопитающих радуют глаз цитолога своей четкой морфологией уже более 50 лет. Когда любуешься ими, не хочется вспоминать, что в живой клетке они никогда не бывают такими. Со школьной скамьи мы привыкли к тому, что в митозе длина хромосом уменьшается. Рисунок на страницах школьного учебника наглядно показывает, как деконденсированные в ядре перед делением хромосомы становятся все короче и короче, превращаясь в конце концов в компактные структуры, которые успешно расходятся в дочерние клетки (рис.6). За этими представлениями стоит многолетний опыт тысяч цитогенетиков. Каждый день при анализе цитологических препаратов перед нашими глазами проходили и сегодня проходят тысячи подобных картин. В школе у любопытных детей обычно возникал вопрос, как же происходит такое изменение размеров и формы хромосом, и как они расходятся, не завязываясь в узлы?
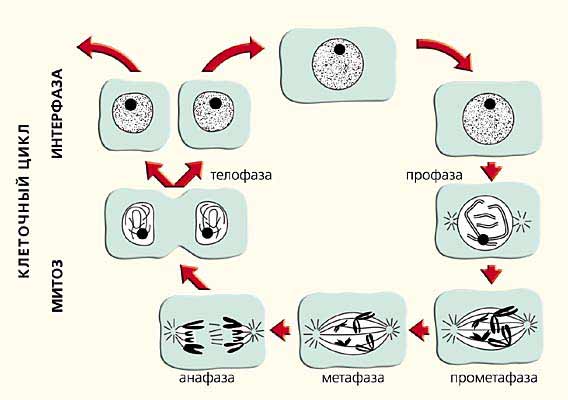
Рис. 6. Схема реорганизации хромосом в клеточном цикле (из школьного учебника).
Теперь мы знаем ответ. Каждая хромосома занимает в ядре свою собственную территорию, не деля ее с другими хромосомам. Оказалось, что не только хромосомы, но и их плечи имеют собственные территории. Наши попытки более детального анализа организации интерфазной хромосомы показали, что отдельные ее районы располагаются в занимаемом ею пространстве примерно в том же порядке, что и в метафазе. Более того, размеры хромосомы в интерфазе близки к таковым в метафазе. Вывод, вытекающий из этих результатов, а также ряда других работ, в которых удалось проследить за движением конкретных участков хромосомы в ядре от середины интерфазы до начала деления, очевиден: при деконденсации-конденсации хромосом не происходит каких-либо глобальных изменений их габаритов и значительных перемещений хромосомных районов, т.е. отношение длины и ширины (толщины) хромосомы почти не меняется.
Невольно возникает вопрос о происхождении длинных, красивых метафазных хромосом, которые мы видим на цитологическом препарате. Благодаря им можно идентифицировать отдельные хромосомы и их районы, выявлять случаи внутри- и межхромосомной реорганизации, определять локализацию конкретных генов и других последовательностей ДНК, а также делать много других полезных и нужных вещей. Но поскольку в живой клетке хромосомы по форме совсем не похожи на метафазные, лежащие на предметном стекле, то надо признать, что такие хромосомы - просто артефакты. Для большинства цитогенетиков это очень обидное слово. Хотя при спокойном размышлении можно прийти к заключению, что огорчаться нечему. Да, в клетке не бывает таких длинных хромосом, да, на цитологическом препарате они выглядят так из-за специальной фиксации материала и его особого нанесения на стекло. Что же меняется в хромосоме при переходе клетки к митозу, и почему эти изменения так влияют на морфологию хромосомы при укладке на предметное стекло?
Суть приготовления препаратов митотических хромосом млекопитающих заключается в распластывании фиксированных клеток на поверхности стекла. Цитоплазма растягивается до почти невидимого слоя, а клеточные ядра превращаются в плоский блин. Самое интересное происходит с метафазными клетками, в которых ядерная оболочка уже разобрана. Весь материал этих клеток растекается тонким слоем, и только хромосомы в состоянии сопротивляться силам, растаскивающим клеточный материал по поверхности стекла. Но и для них такое воздействие не остается незамеченным: их плечи распрямляются, а хроматиды расходятся. Конечно, после разборки ядерной оболочки происходит некоторое передвижение хромосом и, вероятно, небольшое изменение их размеров. Но в метафазе, анафазе и телофазе положение хромосом остается почти таким же, как в предшествующей интерфазе.
При вхождении клетки в митоз способность хромосом сохранять свою форму и размер увеличивается за счет их связывания с белками конденсинами. В результате изменяется укладка хроматина, и хромосомы становятся более устойчивыми к растяжению и распластыванию на стекле во время испарения фиксатора. Кроме этого, в митозе из хромосомных плеч уходит белок когезин, который удерживает рядом сестринские молекулы ДНК, возникшие после удвоения исходной ДНК. Высвобождение когезина приводит к потере связи между сестринскими хроматидами, которые при распластывании хромосом расходятся. В результате двуплечие хромосомы образуют классические Х-подобные фигуры, изображение которых уже многие годы считается символом хромосом.
Несколько сложнее дело обстоит с районами хромосомных плеч, с которыми белки конденсины связываются по-разному. В первую очередь способность сопротивляться растяжению приобретают районы, обедненные генами (так называемые G-бэнды). По этому признаку различаются и районы, обогащенные активно работающими генами (R-бэндами). Более того, вероятно, существует достаточно строгий порядок, согласно которому конденсины связываются с разными R-бэндами, определяя изменения митотической хромосомы от профазы до метафазы. Чем дальше прошла клетка в митозе, тем меньше остается районов, способных к растяжению, и тем короче будет хромосома на цитологическом препарате.
Правда, есть и другой момент в приготовлении цитологических препаратов. Он связан с силой, действующей на хромосомы при их распластывании. Сила эта зависит от комбинации нескольких факторов, изменение которых сложно заметить (например, влажности воздуха). Иногда уже на следующий день качество приготовленных цитологических препаратов катастрофически ухудшается, и происходит это не по вине лаборанта. Механизм, ответственный за растяжение-распластывание хромосомы на стекле, достаточно прост, и заинтересованный читатель может найти его описание в опубликованных статьях [2].
Хромосомы in vivo, in vitro и in silico
Особенно интересно сравнение состава, локализации и порядка конденсации отдельных районов хромосом. В первую очередь реплицируются (а конденсируются в последнюю) районы, обогащенные активно работающими генами. Их растяжение, вероятно, - одна из основных причин выявления в хромосомах чередующихся районов, отличающихся по интенсивности окрашивания. В разложенной на стекле хромосоме выделяются районы R- и G-бэндов.
Но реальная хромосома организована иначе. При изучении распределения районов, обогащенных и обедненных генами (R- и G-бэндов), выяснилось, что в интерфазной хромосоме эти участки не чередуется вдоль хромосомы, как на цитологическом препарате, а распределены между внутренней частью хромосомной территории и ее поверхностью. Вероятно, такое расположение R- и G-бэндов сохраняется и в митотических хромосомах. Только в момент распластывания хромосомы на стекле более рыхлый и эластичный материал R-бэндов в результате растяжения хромосомы перемещается на позицию, совпадающую с пространственной осью хромосомных плеч (рис.7).
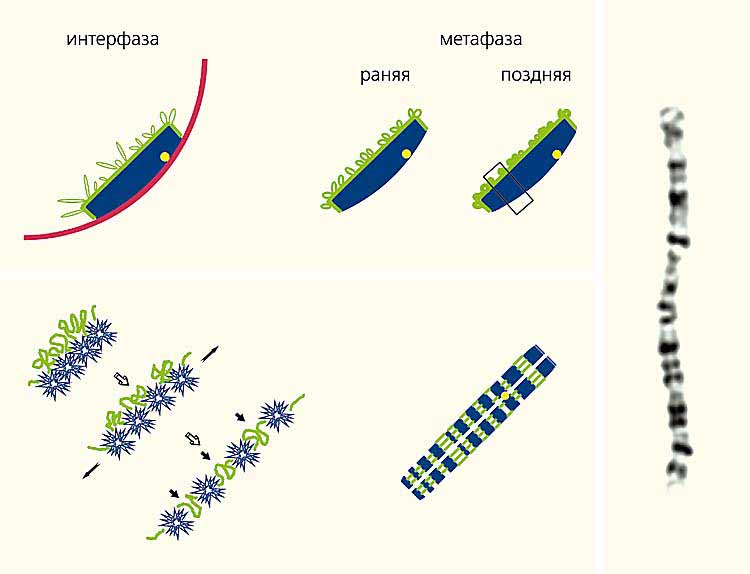
Рис. 7. Предполагаемая схема реорганизации хромосомы в живой клетке в метафазную хромосому на цитологическом препарате.
На оптических срезах хромосомы (вверху) видны районы, обедненные функционирующими генами (G-бэнды, синий цвет); обогащенные активно работающими генами (R-бэнды, зеленый); центромерный район (желтый); ядерная оболочка (красный). Внизу показано движение R- и G-бэндов во время распластывания хромосомы по стеклу (слева) и их расположение в метафазной хромосоме на цитологическом препарате. Справа - фотография GTG-окрашенной второй хромосомы человека на цитологическом препарате.Показано, что в пространстве, занимаемом хромосомой, активно работающие гены находятся на границе ее территории или в непосредственной близости от нее, а неактивный материал спрятан внутри ее территории. Вероятно, это имеет огромное значение для регуляции активности генов. Хромосомная территория окружена межхроматиновым пространством, в котором много ферментов, ответственных за транскрипцию генов и дальнейшее преобразование синтезированной РНК [3, 4]. Проникнуть во внутреннее пространство хромосомной территории этим ферментам непросто. Плотно упакованный хромосомный материал практически не оставляет свободного места для их передвижения внутри хромосомной территории. На какое-то время плотность упаковки ДНК уменьшается. Без этого репликация ДНК внутренних районов хромосомы была бы невозможна. Ведь ферменты репликации должны хоть на непродолжительное время получить туда доступ. Вместе с ними туда имеют шанс проникнуть и ферменты транскрипции. Но их там не может быть много, и активно работать там они не в состоянии.R- и G-бэнды отличаются не только по количеству и составу входящих в них генов, плотности упаковки и пространственной локализации, но и по составу "нехромосомных" белков, находящихся в этих районах. Сравнение ДНК R- и G-бэндов показало множество других отличий, например по составу повторенных последовательностей, по соотношению AT и GC пар нуклеотидов. Достаточно заглянуть в любой учебник или солидный обзор, чтобы выяснить, что R-бэнды обогащены GC парами и короткими диспергированными повторами, тогда как в G-бэндах больше АТ пар и длинных диспергированных повторов.
Казалось бы, знание этих закономерностей позволяет создать виртуальную модель хромосомы, да и всего генома человека. Однако такая модель, построенная на основе известной последовательности нуклеотидов с определенными границами между R- и G-бэндами, оказалась весьма далека от хромосомы in vitro (о хромосоме in vivo и говорить не стоит). Но при сравнении хромосомы in vitro с ее виртуальной моделью был удачно проведен поиск условий, при которых виртуальная модель получалась похожей на реальную хромосому. Выяснилось, что обогащение AT или GC парами имеет значение, если сравнивать районы не в среднем по геному или отдельной хромосоме, а по "ближайшему окружению" (около 9·106 пар нуклеотидов). В этом случае картина виртуальных хромосом получалась очень близкой к схеме R- и G-бэндов анализируемых хромосом.
Хромосома в n-мерном пространстве
Пора вспомнить, что хромосомы - это объекты из реального мира, занимающие в ядре часть трехмерного пространства. Если представить время как еще одну ось координат, то можно попробовать описать хромосому в терминах 4D. Как уже упоминалось выше, благодаря развитию молекулярной биологии и конфокальной микроскопии можно не только "видеть" хромосому в клеточном ядре (рис.5), но даже отличить хромосомные территории нормального гомолога от его перестроенного варианта. Примером может служить наша работа по изучению влияния реорганизации хромосом на их положение в ядрах стволовых клеток человека (рис.8).
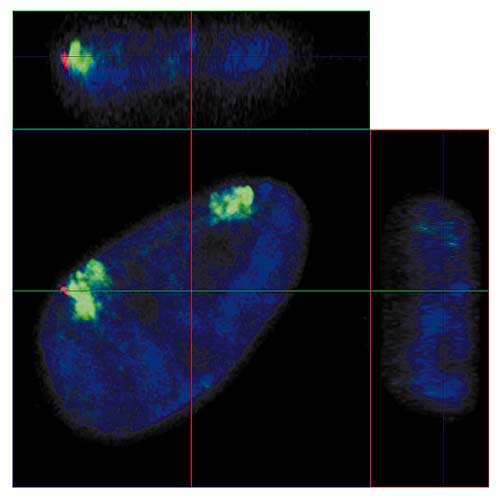
Рис. 8. Ортогональные проекции интерфазного ядра эмбриональной стволовой клетки человека,
в одном из гомологов хромосомы 18 которой потеряна часть короткого и часть длинного плеча.
Зеленым обозначена ДНК хромосомы 18; красным - ДНК из района делеции перестроенной хромосомы 18; синим - ДНК всех хромосом.
Линии показывают положения плоскостей оптических срезов как на рис. 4.К сожалению, обычно жизнь сложнее простых схем, а простые термины могут вносить значительную путаницу. Сегодня описать строение интерфазного ядра нельзя без использования таких понятий, как хромосомная территория и межхроматиновое пространство [5]. Посмотрим повнимательнее, что стоит за этими терминами.
В настоящее время под "хромосомной территорией" понимают ту часть ядра, в которой с помощью гибридизации меченой ДНК и трехмерной микроскопии выявляется хромосомный материал. Межхроматиновым пространством называют ту часть ядра, в которой при использовании стандартных методов и трехмерной микроскопии хроматин не обнаруживается. На самом деле часть материала хромосомы находится за пределами ее территории, а межхроматиновое пространство содержит хроматин. В свете этих данных широко используемая терминология выглядит несколько странно. Но стоит ли удивляться? Вы уверены, что когда-либо видели настоящий белый цвет? Чем он отличается от очень светлого серого? Не было ли там небольшого голубого оттенка? Если нет проблем в понимании того, что имеет в виду ваш собеседник, используя конкретный термин, то нет и проблем, связанных с этим термином.
Что же представляет собой материал хромосомы, имеющийся за ее пределами в межхроматиновом пространстве? Рассмотрим это на примере короткого плеча хромосомы 11 человека. Анализ его локализации в интерфазном ядре показал, что некоторые участки молекулы ДНК находятся далеко за пределами хромосомной территории. Этот факт легко объяснить. Отдельная петля ДНК в ядре не видна при использовании хромосомоспецифичных ДНК-зондов, в то время как FISH с ДНК-зондом, сделанным на базе клонированного фрагмента, дает в интерфазном ядре четкий сигнал (рис.9).
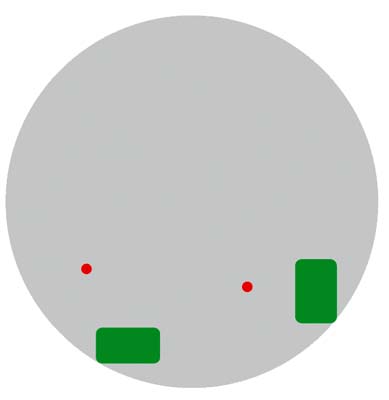
Рис. 9. ДНК хромосомы за пределами хромосомной территории (схема оптического среза).
Серым показано интерфазное ядро; зеленым - территория короткого плеча хромосомы 11 [7].
Красным - фрагмент ДНК из дистального района короткого плеча хромосомы 11.Действительно, из хромосомных территорий в межхроматиновое пространство выходят гигантские петли ДНК. В их составе присутствуют гены, которые должны активно работать в клетке. Они и уходят за пределы хромосомной территории, потому что именно там условия для их работы идеальны. В межхроматиновом пространстве расположены целые комплексы молекул, обеспечивающих синтез информационной РНК и ее дальнейшие преобразования. Есть еще одно преимущество для такого синтеза в межхроматиновом пространстве. Оно не только место локализации фабрик синтеза РНК, но и магистральный путепровод, позволяющий генным продуктам быстро добраться до оболочки ядра, а затем через ядерную пору перейти в цитоплазму для участия в производстве белка.
Остановимся несколько подробнее на работе таких "фабрик транскрипции" (термин, предложенный П.Фрезером, наглядно отражает роль этих макромолекулярных комплексов). Одна такая "фабрика" может одновременно работать с ДНК из разных районов одной хромосомы или даже из разных хромосом. Причем расстояние между генами одной хромосомы может быть более 20 млн пар оснований. Это наглядно показано в опытах, проведенных Фрезером и его коллегами (рис.10).
Возможно, для полного описания хромосомы даже рассмотрение ее в четырехмерном пространстве окажется недостаточным. Иногда очень важна и ее отдаленная история, проявляющаяся в импринтинге соответствующих хромосомных районов. При идентичных геномах (по нуклеотидным последовательностям) возможно появление хорошо различимых нарушений у их владельцев. Так, небольшая делеция в проксимальном районе длинного плеча хромосомы 15 человека может инициировать и синдром Прадена-Вилли, и синдром Энгельмана. Определяющим в формировании патологии служит путь хромосомы в зиготу: проходит ли она через сперматогенез или оогенез.
Как ни печально, но следует признать, что и сегодня едва ли можно рассчитывать на полное описание хромосомы: ее организации, состояния и возможных потенциальных изменений, принципиально важных для реализации в клетке информации, записанной в ее геноме. Но - дорогу осилит идущий.
Значение хорошей системы управления понятно любому человеку. С результатами ее ошибок мы постоянно встречаемся в нашей повседневной жизни. Организм человека намного сложнее хозяйства любого даже самого большого города, и последствия ошибок в работе его генома бывают весьма печальны. Изучение взаимодействий элементов генома в пробирке или их моделирование в компьютере - необходимые этапы изучения генома человека, но их явно недостаточно. Многое определяется непосредственно в клетке с невероятно сложной пространственной организацией ее генома, для понимания которой уже имеются эффективные инструменты. Хочется верить, что эту задачу удастся решить намного быстрее, чем это представляется возможным сегодня.
Работа выполнена при поддержке Российского фонда фундаментальных исследований. Проект 05-04-48221.
Литература
1. Жданова Н.С. Нить Ариадны в генетике // Природа. 2007. №6. С.18-25.
2. Рубцов Н.Б. Методы работы с хромосомами млекопитающих. Новосибирск, 2006.
3. Cremer T., Cremer C. // Nat. Rev. Genet. 2001. V.2. P.292-301.
4. Cremer T., Kreth G., Koester H. et al. // Crit. Rev. Eukaryot Gene Expr. 2000. V.10. №2. P.179-212.
5. Chakalova L., Debrand E., Mitchell J.A. // Nat. Rev. Genet. 2005. V.6. P.669-677.
6. Meaburn K.J., Misteli T. // Nature. 2007. V.445. P.379-381.
7. Mahy N.L. et al. // J. Cell. Biol. 2002. V.159. №5. P.753-763.