№ 8, 2003 г.
© Р.Б.Хайманн, С.Е.Евсюков
Аллотропия углерода
Р.Б.Хайманн, С.Е.Евсюков
Роберт Б.Хайманн, доктор минералогии, профессор,
заведующий кафедрой Института минералогии
при Техническом университете “Фрайбергская горная академия” (Германия).Сергей Евгеньевич Евсюков, кандидат химических наук,
руководитель лаборатории фирмы “instrAction GmbH” (Людвигсхафен, Германия).Надо ли напоминать, что все живое на Земле построено из соединений углерода, что их синтез и распад, превращение одних веществ в другие - основа основ биохимических событий в любой клетке любого организма. Это известно каждому. Как индивидуальный химический элемент углерод был признан Лавуазье в конце XVIII в. и получил свое название (Carboneum) от латинского carbo - уголь. Ни один элемент Периодической системы Менделеева не обладает тем разнообразием свойств, иногда прямо противоположных, которое присуще углероду. Это эталон прозрачности и “абсолютно” черное тело; диа- и парамагнетик; диэлектрик и металл; полупроводник и полуметалл; сверхтвердый и сверхмягкий материал; теплоизолятор и один из лучших проводников тепла. Столь уникальные свойства - причина того, что и чистый углерод, и содержащие его материалы служат объектами фундаментальных исследований и применяются в бесчисленных технических процессах. Все это ярко свидетельствует о его огромной важности для цивилизации.
Значение углерода в современной науке и технике трудно переоценить. П.Уокер, бывший редактором книжной серии “Chemistry and Physics of Carbon”, 30 лет назад писал, что прогресс в разработке новых углеродных материалов будет продолжаться как глава всеобщей истории материаловедения и называл углерод “старым, но всегда новым материалом”. Это выражение, не потерявшее своей актуальности и сегодня, многократно подтверждалось в течение всех минувших лет, и особенно последних десяти.
До начала 60-х годов считалось, что в природе существуют только две кристаллические формы чистого углерода, а именно трех- и двумерные полимеры, т.е. алмаз и графит. Даже “аморфный” углерод долго причислялся к простым формам. Однако к настоящему времени установлено, что по своей структуре в саже, коксе, стеклообразном углероде и им подобных материалах он в разной степени приближается к графиту. Многие исследователи выражали недоумение и считали несколько нелогичным, что существование элемента с самой богатой химией из всей Периодической системы ограничивается лишь двумя аллотропными модификациями. Явно не хватало линейной формы. Правда, в конце ХIХ в. немецкий химик А.Байер пытался синтезировать ее из производных ацетилена, но удача не сопутствовала ему. Одномерный (цепочечный) полимер оставался недостающим звеном в аллотропии углерода вплоть до 1960 г., когда в Институте элементоорганических соединений А.М.Сладковым с сотрудниками был открыт карбин - полииновая, или полиацетиленовая (-СС-)n, и кумуленовая (=C=С=)n формы линейного углерода [1]. Название карбин несколько неудачно, так как совпадает с термином, принятым для обозначения органических трирадикалов Международным союзом фундаментальной и прикладной химии (International Union of Pure and Applied Chemistry, IUPAC). Несмотря на это, название быстро укоренилось и широко используется до настоящего времени исследователями, которые занимаются линейными формами углерода.
Время от времени публикуются научные статьи, в которых авторы заявляют о синтезе новой кристаллической формы или аллотропной модификации углерода. В 1985 г. было открыто большое семейство сферообразных углеродных молекул - фуллеренов [2]. Во всем мире это дало новый и очень сильный толчок исследованиям в области углерода и его аллотропных форм, а авторам открытия через 11 лет - в 1996 г. - принесло Нобелевскую премию по химии [3]. Впоследствии семейство фуллеренов выделили в независимую, часто называемую третьей, аллотропную форму углерода. Можно ли считать их самостоятельной аллотропной модификацией и что представляет собой множество других форм, число которых непрерывно увеличивается и которые исследователи относят к индивидуальным аллотропным?
При попытке понять это возникают два важных вопроса:
- сколько независимых аллотропных форм элементарного углерода может существовать в природе,Чтобы ответить на эти вопросы, обратимся сначала к понятиям аллотропии, полиморфизма и политипизма, поскольку нельзя исключить ошибок в классификации, не дав точного определения таким понятиям.- по каким критериям их следует выделять из множества других углеродных материалов?
Аллотропия - это существование по крайней мере двух форм одного и того же элемента в твердом кристаллическом состоянии, которые отличаются пространственным расположением атомов [4]. Поскольку взаимные превращения аллотропных форм связаны с изменением уравнения состояния вещества, его энергии, термин “аллотропия” следует использовать исключительно в термодинамическом смысле. Понятие полиморфизма имеет в большей мере кристаллографическое значение, так как включает структурные и морфологические изменения. А частный случай одномерного полиморфизма, характерного для некоторых плотноупакованных и слоистых структур, представляет собой политипизм. Это способность вещества кристаллизоваться в виде нескольких модификаций, каждая из которых при двух идентичных параметрах элементарной ячейки отличается лишь третьим, зависимым чаще всего от расстояния между соседними слоями. Политипизм нередко проявляется в структурах, эквивалентных кубической и гексагональной плотной упаковке атомов. В политипных модификациях ближайшее атомное окружение одинаково, а различия обусловлены характером вторых (или даже более удаленных) координационных сфер. Поэтому величины энергии их кристаллических решеток почти равны и, следовательно, очень похожи физические свойства.
Из приведенных понятий аллотропии, полиморфизма и политипизма видно, что они перекрываются и потому трудно вычленить аллотропию, особенно для углерода. Видимо, буквальное понимание того определения, которое дано У.Эддисоном [4], и есть результат открытия огромного и непрерывно увеличивающегося числа аллотропных форм углерода. Не станет ли яснее ситуация, если помимо пространственного расположения атомов углерода учитывать тип химических связей между ними, т.е. тип гибридизации валентных орбиталей [5]? Мы использовали именно это дополнение в качестве отличительной черты аллотропных форм углерода и получили удобную классификационную схему, а затем и третичную диаграмму, которые объединяют в себе все существующие углеродные материалы и те, что пока относят к гипотетическим [6].
Отличительная особенность углерода - способность его s- и p-валентных электронов образовывать гибридные (смешанные) электронные орбитали в различных пропорциях. Этим и объясняется многообразие его химических соединений.
Известно, что атомы углерода могут существовать в трех основных состояниях, соответствующих sp3-, sp2- и sp-гибридизации их валентных орбиталей. Каждое валентное состояние характеризует определенную и единственную аллотропную форму (рис. 1): sp3-тип гибридизации свойствен пространственному (трехмерному) полимеру углерода - алмазу; sp2-тип - плоскостному (двумерному) графиту; sp-тип - линейно-цепочечному (одномерному) карбину. Согласно этой классификации, фуллерены должны иметь нулевую размерность, поскольку их замкнуто-каркасные молекулы при нормальных условиях не образуют полимерных структур, а связаны лишь ван-дер-ваальсовыми взаимодействиями.
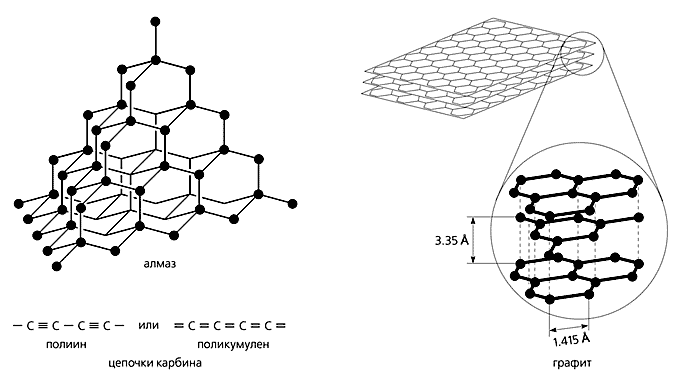
Рис. 1. Схематическое изображение трех основных аллотропных форм углерода.
Любая из трех основных аллотропных форм углерода имеет свои полиморфные структуры и политипы [7]. Алмаз, например, существует в виде кубической и гексагональной полиморфных модификаций (вторую называют лонсдейлитом), а также четырех политипных. У графита тоже две формы: гексагональная и ромбоэдрическая, отличающиеся типом чередования углеродных слоев (ABAB и ABCA соответственно). А кроме того - несколько политипов. Наконец, для гексагонального карбина до настоящего времени описаны только политипные модификации: a- и b-карбин, чаоит и несколько форм, не имеющих названий, а просто обозначаемых порядковыми номерами при углероде, например CVI, CVIII–XII. Политипы карбина различаются длиной линейных цепочек углерода, которая, по-видимому, в некоторых случаях зависит от температуры их образования.
Алмаз и графит на протяжении многих лет были предметом детальных исследований и поэтому всесторонне изучены и охарактеризованы. Но однозначных и строгих доказательств индивидуальности карбина и его строения до сих пор, к сожалению, не получено. Он не включен в список терминов, недавно рекомендованных IUPAC для описания углерода как твердого тела. Однако существует большое количество публикаций о карбине, есть критические обзоры накопленных экспериментальных данных [8], разработаны новые подходы к синтезу и методы анализа линейных форм углерода. Заметно возрос в последние годы и интерес к ним. На основании всего этого можно ожидать, что существование карбина вскоре будет непреложно установлено.
Помимо рассмотренных уже трех аллотропных модификаций, существуют и другие формы элементарного углерода. Они составляют множество так называемых переходных форм [9]. Их в свою очередь можно разделить на две большие группы - смешанные и промежуточные формы.
В первую группу следует включить “аморфный”, алмазоподобный и стеклообразный углерод, а также сажу, кокс и подобные им материалы. Такие формы со смешанным ближним порядком состоят из более или менее случайно организованных атомов углерода различной гибридизации. К этой же группе могут быть отнесены также многочисленные гипотетические структуры (рис. 2): графины, некоторые полициклические модификации в виде трехмерных углеродных сеток, “металлический углерод” и сходные с ними структуры на основе алленовых (=C=C=) или диацетиленовых (–CBC–CBC–) фрагментов, которые расположены между ортогональными полиеновыми или полидиацетиленовыми цепочками. “Супералмаз” и слоисто-цепочечный углерод (т.е. гибридные карбино-алмазные структуры, в сущности представляющие собой частный случай одномерного “супералмаза”) тоже относятся к смешанным формам углерода. Методологические основы синтеза таких форм подробно рассмотрены в исчерпывающих обзорах Ф.Дидериха и И.Рубина [10, 11].
Рис. 2. Смешанные гипотетические формы: плоскостной “графин”; трехмерная сетка “металлического углерода”; “супералмаз” и карбино-алмазный гибрид (слоисто-цепочечный углерод).Вторая группа объединяет промежуточные формы углерода (рис. 3). Степень гибридизации углеродных атомов в них можно выразить как spn, где n не целое, а дробное число: 1 < n < 3, n № 2. Эту группу в свою очередь можно разделить на две подгруппы. Первая из них включает углеродные моноциклы, в которых 1 < n < 2. Другую подгруппу составляют промежуточные формы с 2 < n < 3: различные замкнуто-каркасные структуры, такие как фуллерены [12] и углеродные нанотрубки, или тубулены [13].
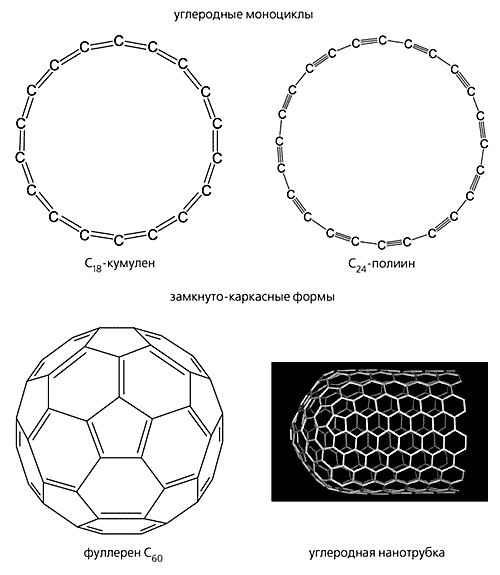
Рис. 3. Промежуточные формы углерода: углеродные моноциклы и замкнуто-каркасные структуры.
Дробная степень гибридизации в промежуточных формах - следствие изогнутости и напряженности углеродного скелета. Например, в молекуле C60, наиболее детально изученного члена семейства фуллеренов, она равна 2.28 [14]. Некоторые гипотетические формы в виде полициклических углеродных сеток могут быть тоже приписаны к промежуточным при условии, что они содержат напряженные циклы (рис. 4).
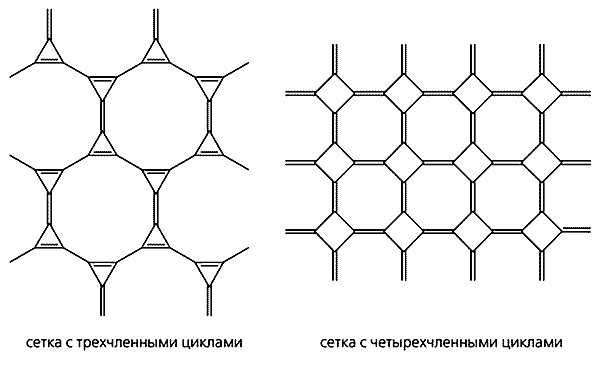
Рис. 4. Гипотетические формы в виде полициклических сеток
с напряженными трех- и четырехчленными циклами.В некоторых случаях, однако, наряду с геометрическими параметрами следует принимать во внимание и электронные взаимодействия. Например, структура “металлического углерода”, состоящая из регулярно сшитых гофрированных слоев ортогональных полиеновых цепочек (см. рис. 2), свободна от угловых напряжений, но не свободна от электронных “p-напряжений”. p-Облака соседних полиеновых цепочек из-за поперечных сшивок вынуждены находиться слишком близко друг к другу, делая тем самым всю структуру “металлической” [15].
Приведенные здесь аллотропные формы углерода укладываются в созданную нами общую схему классификации и родственную ей, более наглядную, третичную диаграмму (рис. 5). И та и другая основаны на типе гибридизации валентных орбиталей углерода. Эта диаграмма объединяет в себе основные аллотропные формы (существующие и предполагаемую), а также все переходные (как смешанные, так и промежуточные). В вершинах треугольника располагаются алмаз (вместе с лонсдейлитом), графит и карбин, а по сторонам и внутри - переходные формы.
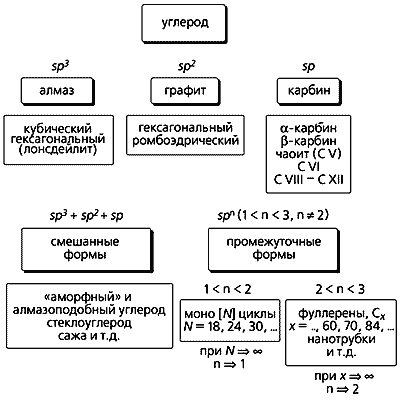
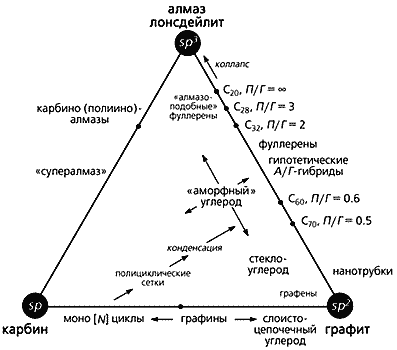
Рис. 5. Классификационная схема и третичная диаграмма аллотропных форм углерода.
П/Г - соотношение пента- и гексагонов; А/Г – алмазо-графитные гибриды.Структуры со степенью гибридизации spn (2 < n < 3) находятся вдоль стороны sp2–sp3 (т.е.между графитом и алмазом) и объединяют фуллерены, алмазо-графитные гибриды и углеродные нанотрубки. Положение каждого члена Cх семейства фуллеренов на стороне sp2–sp3 зависит от соотношения пяти- и шестичленных циклов (или пента- и гексагонов, П/Г) в их молекулах. Если соотношение стремится к 0, это соответствует sp2-гибридизации, т.е. чистому графиту. При отсутствии шестичленных циклов П/Г ® Ґ, как в “алмазоподобном” кластере C20, состоящем только из пентагонов. Вследствие нарушения правила изолированных пятичленных циклов кластер C20 нестабилен и можно было бы ожидать его коллапса, превращения в алмазную структуру. И действительно, было установлено, что при осаждении углеродных кластеров такого размера (~C20), полученных методом лазерной возгонки, на подложке образуется алмазоподобный углерод с почти чистой sp3-гибридизацией.
На стороне треугольника sp–sp2 (между карбином и графитом) тоже располагаются углеродные формы со степенью гибридизации spn, но при 1 < n < 2. К таким формам относятся моно[N]циклы, где N - количество атомов углерода в цикле, равное 18, 24, 30 и т.д. [10, 11]. Предполагается, что реакции этих форм играют ключевую роль в образовании фуллеренов. Когда плоские углеродные циклы сливаются, возникают новые полициклические структуры, способные конденсироваться с образованием фуллеренов. Если же растут дальше, то могут снова участвовать в процессах полимеризации или служить центрами нуклеации - “зародышами”, из которых возникают углеродные нанотрубки. Полииновые цепочки (в них чередуются одинарные и тройные связи) могут сворачиваться спиралью вокруг конденсированных ароматических фрагментов и подвергаться серии последовательных реакций сшивки наподобие застежки “молния”. И в этом случае тоже образуются фуллерены.
Углеродные формы в виде напряженных полициклических сеток с высокой степенью конденсации представляют собой “графины”, плоские многослойные структуры. Они получаются, если одну треть углерод-углеродных связей в шестичленных циклах графита заменить sp-гибридизованными ацетиленовыми (–CC–) фрагментами. Плоские слои “графина” связаны между собой, как и в графите, ван-дер-ваальсовыми взаимодействиями. В отличие от этого, гипотетические карбино-графитовые гибридные формы, приписываемые к так называемому слоисто-цепочечному углероду, построены из высоконапряженных графитовых слоев, которые частично соединены короткими углеродными цепочками в направлении кристаллографической оси c [16].
Третья сторона (sp-sp3) треугольника, идущая от карбина к алмазу, до настоящего времени еще слабо охарактеризована. Помимо архетиповых аллотропных форм (алмаза и лонсдейлита) с sp3-гибридизацией, обнаружена еще одна sp3-форма, названная суперкубаном, или C8. По плотности она превышает даже алмаз. Изначально рассчитанные длины связей в кубах (1.42 A) и между ними (1.23 A) оказались слишком короткими для алмазной sp3-гибридизации. Чтобы объяснить столь плотную упаковку атомов, была предложена альтернативная структура, аналогичная высокобарической форме кремния (g-Si). Длины связей в кубах такой структуры составляют 1.54 A, а шестичленные углеродные циклы находятся в скрученной конформации, которая напоминает ванну [17].
Из гипотетических форм стоит упомянуть еще карбино(полиино)-алмаз. Предполагают, что он соответствует упомянутому одномерному “супералмазу” (см. рис. 2): состоит из складчатых алмазоподобных слоев, в которых конденсированные углеродные циклы имеют конформацию кресла и регулярно связаны друг с другом короткими углеродными цепочками sp-типа, перпендикулярными этим слоям [16]. Такие структуры были предложены в качестве переходных фаз при превращении графита в алмаз под действием ударной волны. Наконец, возможно также существование трехмерной “супералмазной” решетки, в которой все sp3-атомы алмазной структуры соединены между собой диацетиленовыми фрагментами.
Формы углерода, расположенные внутри треугольника (см. рис. 5), характеризуются вкладом всех трех типов гибридизации в различных комбинациях. Они принадлежат главным образом к рассмотренным уже смешанным формам. К таковым относятся, в частности, “аморфный” и стеклообразный углерод с преобладанием sp2-гибридизации. Не исключено, однако, что реально существующие комплексные углеродные материалы и углерод-углеродные композиты содержат случайно распределенные структурные элементы промежуточных типов гибридизации. Строение и количество этих элементов должны зависеть от метода и условий синтеза.
Можно представить и другие, еще более сложные углеродные материалы, состоящие из структурных элементов как смешанного, так и промежуточного типа. Подобные матералы могут быть получены, например, полимеризацией фуллереновых молекул и углеродных нанотрубок, а также при взаимных превращениях различных форм углерода: карбина в алмаз или графит, фуллеренов в алмаз, графит или карбин.
Таким образом, разделение углеродных форм и материалов в соответствии с типом гибридизации валентных орбиталей их атомов представляется наиболее простой и удобной схемой классификации. Согласно этой схеме, все многообразие форм углерода можно условно разбить на две группы: архетиповые аллотропные с целым показателем степени гибридизации (алмаз, графит, карбин) и переходные. Последние включают смешанные формы, содержащие структурные элементы всех архетиповых модификаций в различных комбинациях, и промежуточные формы с дробным показателем степени гибридизации (моноциклы, фуллерены, нанотрубки и др.).
третичная диаграмма форм углерода, рассмотренная в этой статье, в полной мере отражает общность, взаимосвязь и многообразие форм углерода, демонстрируя известное в философии единство общего и особенного, единичного. Насколько во всем мире велик интерес к разнообразным углеродным формам, можно судить хотя бы по фуллеренам. Они привлекают специалистов из самых разных областей естествознания: химиков возможностью получать громадные, тысячеатомные, молекулы и целенаправленно модифицировать их, присоединяя функциональные органические фрагменты; физиков - необычными электронными, оптическими и магнитными свойствами газообразной и твердой фаз; астрофизиков - предполагаемым присутствием в межзвездных облаках (здесь уместно упомянуть, что по иронии судьбы фуллерены были открыты при попытке синтезировать одномерные углеродные цепочки, т.е. карбиновые структуры, которые также входят в состав межзвездной материи); геологов и минералогов - существованием в очень древних карельских шунгитах. Излишне говорить о ценности и потенциальной полезности всего комплекса физико-химических свойств этих замкнуто-каркасных форм углерода для материаловедов и приборостроителей.
Можно надеяться, что недалекое будущее принесет еще много неожиданных и поразительных открытий в науке об углероде, элементе, на котором основана жизнь на Земле.
Литература
1. Сладков А.М., Кудрявцев Ю.П. Алмаз, графит, карбин - аллотропные формы углерода // Природа. 1969.№5. С.37-44.
2. Kroto H.W., Heath J.R., O’Brien S.C. et al. // Nature. 1985. V.318. P.162-163.
3. Чернозатонский Л.А. // Природа. 1997. №1. С.96-99.
4. Эддисон У. Аллотропия химических элементов. Пер. с англ., М., 1966.
5. Terms concerned with CARBON as chemical element and its reactivity // Proc. 5th London Int. Carbon Graphite Conf. (Sept. 18–22. 1978). 1979. V.3. P.103-108.
6. Heimann R.B., Evsyukov S.E., Koga Y. // Carbon. 1997. V.35. P.1654-1658.
7. Ман Л.И., Малиновский Ю.А., Семилетов С.А. // Кристаллография. 1990. Т.35. С.1029-1039.
8. Carbyne and Carbynoid Structures / Ed. R.B. Heimann, S.E. Evsyukov, L. Kavan. Dordrecht, 1999.
9. Касаточкин В.И. Переходные формы углерода // Структурная химия углерода и углей /Ред. В.И. Касаточкин. М., 1969. С.7-16.
10. Diederich F., Rubin Y. // Angew. Chem. Int. Ed. Engl. 1992. V.31. P.1101-1123.
11. Diederich F. // Nature. 1994. V.369. P.199-207.
12. Fullerenes. Chemistry, Physics, and Technology / Ed. K.M. Kadish, R.S. Ruoff. N. Y., 2000.
13. Harris P. J. F. // Carbon Nanotubes and Related Structures: New Materials for the 21st Century. N. Y., 1999.
14. Haddon R.C. // Phil. Trans. Roy. Soc. London. Ser. A - Phys. Sci. Eng. 1993. V.343. P.53-62.
15. Hoffmann R., Hughbanks R., Kertesz M., Bird P.H. // J. Am. Chem. Soc. 1983. V.105. P.4831-4832.
16. Мельниченко В.М., Никулин Ю.Н., Сладков А.М. Слоистая структура алмаза // Природа. 1984. №7. С.22-30.
17. Johnston R.L., Hoffmann R. // J. Am. Chem. Soc. 1989. V.111. P.810-819.
Июль 2003