№6, 2007 г.
© Кочетов А.В.
Генная инженерия и растения
А.В.Кочетов
Алексей Владимирович Кочетов, к.б.н., зав. лаб. генной инженерии растений.Работы по получению и исследованию трансгенных организмов в нашем институте были начаты еще в 1974 г., т.е. на заре развития молекулярной генетики, когда только-только были разработаны методы получения рекомбинантных молекул ДНК. Эти подходы оказались полезны не только для фундаментальных, но и прикладных исследований и дали начало новому направлению развития биотехнологии. По понятным причинам эта область науки привлекла огромное внимание и очень быстро развивалась. Появились методы, позволяющие встраивать в геном растения или любого другого организма чужеродные гены (трансгеноз), в результате чего клетки таких организмов начинают синтезировать новые белки, не свойственные этому виду в природе. Так, нашим сотрудникам впервые в СССР удалось сначала химически синтезировать гены гормона человека ангиотензина I и затем наработать этот белок в клетках кишечной палочки. Вскоре был синтезирован еще и ген b-интерферона человека, который был встроен в растения табака и люцерны, приобретшие таким образом устойчивость к вирусным инфекциям. Эти работы проводились в начале 80-х годов в лаборатории В.К.Шумного, а в 1991 г. был создан сектор генной инженерии растений (под руководством М.И.Ривкина), где к настоящему времени получены десятки различных линий трансгенных растений. Подробно рассказать обо всех этих разработках в рамках одной статьи невозможно, поэтому ограничимся лишь двумя примерами, иллюстрирующими современные тенденции в генной инженерии растений.
C трансгенозом и без
Выбор гена (точнее, генетической конструкции) для трансгеноза, естественно, зависит от поставленной задачи. Поскольку нашей задачей было получение вирусоустойчивых растений табака, в качестве основных элементов генетической конструкции были выбраны гены рибонуклеаз, обладающих противовирусной активностью, - неспецифической нуклеазы из генома бактерии Serratia marcescens и панкреатической рибонуклеазы быка (рис.1).

Рис. 1. Схема получения генетически модифицированных растений.
На первом этапе осуществляется выделение трансгена из геномной ДНК (или кДНК) организма-донора. Возможно два основных варианта генетических конструкций: содержащих белок-кодирующие трансгены (конструкция 1) или участки генов, расположенные в антисмысловой ориентации (конструкции 2 и 3). Обозначения: RB, LB - повторы, маркирующие участок ДНК в векторе, который переносится в геном растений ферментами агробактерии; NPTII - ген, экспрессия которого позволяет растениям-трансформантам расти на антибиотике канамицине; РНКаза - ген панкреатической рибонуклеазы быка; ПДГ - участки гена пролиндегидрогеназы арабидопсиса, размещенные в антисмысловой ориентации; pMAS, p35S - промоторы, управляющие экспрессией трансгенов.Выделить необходимый фрагмент ДНК из генома организма-донора в наши дни особого труда не составляет, гораздо сложнее решить, под какое управление следует поместить трансген. Дело в том, что активность (экспрессия) большинства генов строго регулируется, и работают они в определенных тканях или органах, на определенных стадиях развития или при воздействии специфических внешних факторов. Помимо этого надо учитывать, что регуляция осуществляется и на количественном уровне - интенсивность экспрессии гена может меняться в широких пределах. Основная информация о режиме экспрессии содержится в промоторе - участке ДНК, расположенном перед белок-кодирующей последовательностью. Фермент РНК-полимераза распознает сигналы, расположенные в промоторе, и инициирует синтез матричной РНК (мРНК), на основе которой рибосомы синтезируют белок.Итак, нам необходимо было в первую очередь выбрать режим экспрессии (т.е. подобрать промотор), который был бы наиболее выгодным для синтеза белка с противовирусной активностью. Однако и здесь, как выяснилось, есть свои “подводные камни”. С одной стороны, постоянный синтез целевого белка в большинстве тканей растений имеет определенные преимущества - создается нуклеазный “барьер” для вируса чуть ли не во всех клетках растения. С другой стороны, непрерывный синтез чужеродного белка на высоком уровне перегружает аппарат экспрессии растительных клеток и может снизить жизнеспособность растения [1]. Кроме того, постоянное присутствие защитного белка может стимулировать отбор мутационных вариантов вируса, устойчивых к этому фактору. С учетом всех этих нюансов в конструкцию был вставлен промотор гена маннопинсинтазы (pMAS), обеспечивающий средний уровень экспрессии трансгена в листьях и корнях растения и высокий - в клетках, окружающих поврежденные ткани. Поскольку вирусы часто проникают в растение именно в таких местах (например, при укусах насекомых), выбранная схема работы трансгена представлялась оптимальной.
На следующем этапе необходимо было определить способ трансгеноза. Для двудольных растений наиболее эффективным способом генетической трансформации считается перенос генетического материала с помощью природного “генного инженера” - почвенной бактерии Agrobacterium tumefaciens. Специфические белковые комплексы агробактерий вырезают генетическую конструкцию, переносят ее из бактерии в клетку растений и встраивают в геномную ДНК. Для отбора трансформантов используют различные генетические маркеры: в данном случае в конструкции был использован ген неомицинфосфотрансферазы II, обеспечивающий устойчивость клеток растений к антибиотику канамицину.
Кусочки листьев табака, обработанные суспензией агробактерий, выдерживали на средах, содержащих гормоны роста растений и канамицин (см. рис.1). Полученные в результате прямой селекции устойчивые к антибиотику растения табака проанализировали на содержание трансгена и на синтез целевого белка. Ткани трансгенных растений и их потомков содержали панкреатическую рибонуклеазу быка и обладали существенно более высоким уровнем нуклеазной активности (в 7-10 раз выше по сравнению с нетрансгенными растениями).
Заключительный этап всех подобных экспериментов - испытания созданных генными инженерами растений. Их провели сотрудники Биолого-почвенного института ДВО РАН (В.И.Малиновский и М.В.Супоцкий), которые заключили: генетически модифицированные варианты табака значительно устойчивее к вирусу табачной мозаики, чем их “обычные” сородичи; если же концентрация вируса была не очень высока, трансгенные растения вообще не проявляли симптомов инфекции [2]. Таким образом удалось, во-первых, проверить предположение о роли нуклеаз в системе противовирусной защиты растений и, во-вторых, предложить новый способ получения вирусоустойчивых форм растений. Более того, появилась возможность целенаправленно улучшать уже существующие сорта сельскохозяйственных растений при сохранении всего (часто уникального) комплекса их ценных характеристик. К примеру, высокопродуктивный и устойчивый к фитофторе сорт картофеля можно сделать еще и вирусоустойчивым.
Есть еще один вариант создания генетически модифицированных растений, при котором генетическая конструкция не содержит трансгенов, кодирующих белок. В этом случае используется феномен так называемого генетического сайленсинга (от англ. silencing - глушение), который используется, когда нужно отключить или снизить активность одного из собственных генов растения. В основе этого метода лежит открытие фундаментального явления РНК-интерференции (подавления экспрессии генов с помощью двуцепочечной РНК), за которое в прошлом году была присуждена Нобелевская премия *.
* Подробнее см.: Кленов М.С. Лауреаты Нобелевской премии 2006 года. По физиологии или медицине - Э.Файер и К.Мэлоу // Природа. 2007. №1. С.76-79.Для того чтобы выключить ген-мишень, можно поступить следующим образом: выделить этот фрагмент ДНК из генома и поместить его в генетическую конструкцию в перевернутом (антисмысловом) положении (рис.2). При этом будет синтезироваться РНК, которая ничего не кодирует, но обладает способностью связываться с мРНК гена-мишени. Сформировавшиеся двуцепочечные участки включают древние механизмы посттранскрипционного генетического сайленсинга - остановку трансляции, разрушение мРНК и резкое снижение или даже полное прекращение экспрессии гена-мишени.
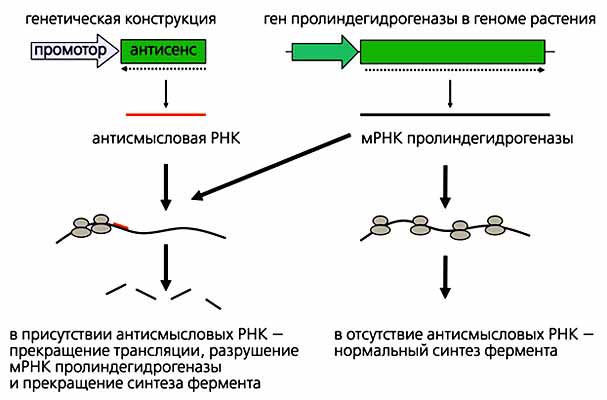
Рис. 2. Синтез “антисмысловых” РНК ингибирует экспрессию гена-мишени на посттранскрипционном уровне.
С этой целью используют генетические конструкции, в которых участок гена мишени расположен в “перевернутом” (антисмысловом) положении. Антисмысловая РНК ничего не кодирует и взаимодействует с мРНК гена мишени. В результате такого взаимодействия экспрессия гена-мишени резко снижается или прекращается вовсе.В качестве примера приведем эксперимент по получению растений табака, несущих антисмысловой участок гена пролиндегидрогеназы - фермента, разрушающего аминокислоту пролин. Известно, что пролин активно синтезируется в клетках растений в ответ на разные стрессовые воздействия (засоление, засуху, холод и др.). Эта аминокислота обладает уникальными свойствами - ее раствор в воде даже в высоких концентрациях не нарушает структуру белков, поэтому она может “работать” в качестве осмопротектора. Уровень пролина (как и других метаболитов) в растениях определяется балансом синтеза и распада, поэтому увеличить содержание пролина в растениях (и повысить их стрессоустойчивсть) можно либо усилив его синтез, либо снизив скорость его распада.Для инактивации гена пролиндегидрогеназы был создан набор специфических генетических конструкций, транскрибирующих антисмысловую РНК (см. рис.1, конструкция 2). Эти варианты генетических конструкций содержат минимальные количества чужеродной ДНК - лишь небольшие участки нуклеотидной последовательности вектора (см. рис.1, конструкция 3). В них не был вставлен даже ген, обеспечивающий устойчивость клеток растений к антибиотику, поскольку в качестве селекционного фактора при отборе трансгенных растений использовался не антибиотик, а стрессовый фон (в данном случае ткани растений выдерживали на средах, содержащих соль или токсичные аналоги пролина).
Анализ полученных таким образом растений табака подтвердил снижение у них активности пролиндегидрогеназы, что сказалось на увеличении содержания пролина и повышении неспецифической стрессоустойчивости (к засолению, засухе, солям тяжелых металлов и др.). Следовательно, была уточнена роль пролиндегидрогеназы и предложен метод получения стрессоустойчивых форм растений [3]. Поскольку во введенных в геном генетических конструкциях нет белок-кодирующих генов (а значит, состав белков качественно не изменился), то такие растения можно, по-видимому, называть генетически модифицированными нетрансгенными растениями.
Экономическая выгода
Первые коммерческие варианты генетически модифицированных растений были разрешены к использованию в 1994 г., а спустя всего два года их выращивали в шести странах мира на площади около 1.7 млн га. В 2005 г. эти растения уже занимали 90 млн га в 21 стране, а в 2006 г. - более 102 млн га в 22 странах (таблица).
До недавнего времени большинство всех выращиваемых трансгенных сортов растений содержали либо ген устойчивости к гербицидам (71%), либо ген устойчивости к вредителям (18%) и лишь немногие (11%) - оба гена одновременно. Сейчас создаются генетически модифицированные растения, которые будут устойчивы не только к фитопатогенным вирусам, бактериям, грибам, нематодам и насекомым, но и к засухе, заморозкам, засолению и т.д., при этом у них будет снижена аллергенность и повышена пищевая ценность (возрастет содержание незаменимых аминокислот, витаминов и т.д.) и усвояемость. Уже существует салат с увеличенным содержанием железа, обогащенная лизином кукуруза, рис, содержащий большее количество триптофана, а также “золотой рис”, названный так из-за ярко-желтой окраски эндосперма, в составе которого много
b-каротина. В азиатских странах уже культивируются модифицированные сорта риса, способные в будущем полностью обеспечить население необходимым количеством витамина А [4].
Вполне вероятно, что в недалеком будущем будут созданы генетические модификации, в которых задействованы десятки и сотни взаимосвязанных генов, существенным образом изменяющих фенотип, физиологические и биохимические характеристики растений. Такие генетически модифицированные растения помогут решить самые сложные проблемы сельского хозяйства - адаптировать растения к выращиванию в климатически неблагоприятных районах и на проблемных почвах, максимизировать их продуктивность и пищевую ценность. В настоящее время при планировании генетических модификаций используется информация, полученная при полномасштабном исследовании транскриптома (совокупности транскриптов) и протеома (всех белков) растительной клетки. Кроме того, проводится сравнительный анализ различных генотипов растений (например, сравнение чувствительного и устойчивого к фитопатогену сортов растений). Все эти данные позволяют реконструировать генные и метаболические сети, определяющие возможные мишени для внесения генетических модификаций.
Особого внимания заслуживает производство в трансгенных растениях белков медицинского назначения (интерферонов, интерлейкинов, факторов роста, антител и др.). Работы в этом направлении ведутся и в нашем институте в лаборатории гетерозиса растений под руководством В.К.Шумного, где, в частности, получены сорта табака и моркови, экспрессирующие некоторые интерлейкины человека. Такие “фабрики” биологически активных веществ при соблюдении определенных условий (идентичности структурно-функциональных характеристик нативного варианта белка и трансгенных вариантов, надежной и эффективной системе выделения и очистки из тканей растений) экономически выгоднее, чем, например, выделение белков из культуры клеток человека или крови.
Отдельно следует упомянуть о так называемых “живых вакцинах” - растениях, синтезирующих белок какого-либо патогена, к которому у человека или животного, съевших такое растение, должен развиться иммунитет. В литературе описаны уже десятки подобных генетически модифицированных растений, многие из которых в настоящее время уже проходят клинические испытания и вскоре, по-видимому, могут быть использованы для массовой вакцинации в странах с низким уровнем жизни населения, поскольку крайне дешевы в производстве. Очень перспективный подход для создания биопродуцентов и “живых вакцин” - экспрессия чужеродных генов не в ядерном геноме растений, а в геноме хлоропластов. Эта технология более безопасна и позволяет получать высокие уровни наработки белков. Согласно литературным данным, получены растения-биопродуценты g-интерферона, соматотропина и сывороточного альбумина человека, “живые вакцины” против сибирской язвы, чумы, холеры, гепатитов В и С и др. [5].
Биобезопасность
Если экономическая выгода от использования генетически модифицированных растений очевидна (к слову, их выращиванием занимается около 10 млн фермеров), то их безопасность по-прежнему вызывает жаркие споры, давно вышедшие за пределы лабораторий и научных форумов. И это несмотря на то, что до сих пор не получено ни одного достоверного подтверждения вредоносных качеств ни одного из этих растений. Преувеличение их опасности, надо сказать, часто связано с недостатком знаний и информации.
По понятным причинам наибольшее беспокойство вызывает вероятность переноса генетического материала трансгенного растения в геномы других организмов. “Утечка” трансгена в сельскохозяйственные или дикорастущие родственные виды может произойти в результате скрещиваний. Такие ситуации стараются предотвращать: используют растения-самоопылители, изолируют посевы трансгенных растений, тщательно анализируют возможные последствия такого переноса и вероятность фиксации трансгена в популяциях диких или культурных растений и т.д.
Однако чаще в средствах массовой информации обсуждается возможность внедрения трансгенов в геномы почвенных микроорганизмов, организмов-симбионтов желудочно-кишечного тракта животных (в том числе человека) и, наконец, в геном самого человека, что, естественно, вызывает наиболее выраженный эмоциональный отклик в обществе.
К сожалению, мало кто задумывается, что человек, как и все прочие гетеротрофные организмы, постоянно сталкивается с огромным количеством чужеродной ДНК (около 0.1% ее содержится в пище, не говоря уж о разнообразных микроорганизмах - симбионтах и паразитах). Ранее считалось, что пищеварительная система млекопитающих, содержащая большое количество неспецифических нуклеаз, - непроницаемый барьер для чужеродной ДНК (за исключением специализированных вирусов). Однако небольшой ее “дрейф” в клетки человека, оказывается, возможен. Этот вывод основан на результатах экспериментов, в которых в рацион мышей добавляли препараты, содержащие маркерные ДНК, - их фрагменты выявлены в ядрах некоторых клеток эпителия желудка и кишечника, а также клеток крови (лейкоцитов), печени, почек и селезенки мышей [6].
Важно понимать, что между трансгенами и “обычными” генами, поступающими с пищей, нет никакой разницы. К примеру, в некоторых клетках пищеварительной системы мышей, которых кормили соей, обнаружены фрагменты ее генов. Да и в клетках крови людей - добровольных участников эксперимента, которых “угощали” мясом кролика (приготовленным, не сырым!), - найдены небольшие фрагменты как геномной, так и митохондриальной ДНК кролика [7]. Учитывая все это, следует спокойнее, на наш взгляд, относиться и к результатам проверки генетической безопасности трансгенных растений. Действительно, в клетках крови, печени, селезенки и почек свиней, которых кормили трансгенной кукурузой, несущей ген инсектицидного Bt-токсина, обнаружены не только фрагменты различных генов растения, но и небольшие функционально неактивные участки трансгена. Обращаю внимание, что в этой серии экспериментов и те, и другие нуклеотидные последовательности ДНК выявлены в соматических, а не в клетках зародышевой линии, поэтому ни о какой передаче чужеродного генетического материала потомству говорить не приходится. Кроме того, еще никому не удалось обнаружить экспрессию проникших с пищей фрагментов генов или какие-то негативные последствия их присутствия. Ясно, что природа умеет справляться с любой чужеродной ДНК, и тем более трансгенной, доля которой столь ничтожна, что просто неразумно предполагать, что она будет обладать специальным вредоносным эффектом.
Противники генетической трансформации растений говорят также о непредсказуемом влиянии трансгена на метаболизм и биохимию самого растения: новый ген может вызвать нарушение работы генов (их модификацию, выключение или активацию), что теоретически может привести к синтезу метаболита с токсическим или онкогенным эффектом. Вероятность такого события крайне мала и в равной степени относится к обычной селекции, последствия которой столь же (если не более) непредсказуемы, однако об этом никто, как правило, не говорит.
Вспомним, как получают новый сорт растения традиционными методами, без трансгеноза. Во многих случаях этот процесс включает мутагенез с помощью радиоактивного излучения или химических препаратов, отбор “перспективных” мутантов с искомыми характеристиками и создание нового сорта с помощью серии скрещиваний и тщательного отбора. Даже если мутагенез не используется, любой новый сорт представляет собой оригинальную уникальную комбинацию аллелей (природных вариантов генов), полученную при скрещивании различных (непохожих друг на друга) представителей данного вида. Вероятность того, что в результате этих манипуляций в метаболизме растения нового сорта произойдут сдвиги с негативным эффектом, точно такая же, как при трансгенозе или даже выше. Однако в данном случае никто не обсуждает эту потенциальную опасность всерьез, поскольку селекция сельскохозяйственных растений практикуется человеком тысячи лет и рассматривается в качестве одного из ключевых достижений нашей цивилизации.
Безусловно, следует тщательно оценивать возможные негативные последствия от попадания чужеродной ДНК в клетки желудочно-кишечного тракта человека и геномы микроорганизмов-симбионтов, а также детально анализировать биологическую безопасность пищи, в состав которой входят трансгенные растения. Так и делается. Однако нет никакой необходимости a priori считать такую пищу “генетически” опасной, основываясь только на факте присутствия трансгена: во всех разрешенных случаях эти гены кодируют безопасные для человека белки. Уже пора признать, что мы живем в окружении чужеродных ДНК, и появление в геноме сельскохозяйственных растений или животных новых генов не меняет ситуацию качественно, равно как и отказ от генной модификации организмов ни в коей мере не решит проблему “генетической” безопасности. Единственный (и естественный для Homo sapiens) выход в такой ситуации - развивать науку и исследовать природу, не останавливаясь на достигнутом и не подменяя реальные ситуации и опасности вымышленными.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проекты 02-04-4508 и 05-04-48207)
и Государственной программы исследований научных школ Российской Федерации (528.2006.4).Литература
1. Gurr S.J., Rushton P.J. // Trends Biotechnol. 2005. №23. Р.275-282.
2. Trifonova E.A., Sapotsky M.V., Komarova M.L. et al. // Plant Cell Reports. 2007. (в печати; PMID: 17242942)
3. Колодяжная Я.С., Титов С.Е., Кочетов А.В. и др. // Генетика. 2006. №42. С.278-281.
4. Paine J.A., Shipton C.A., Chaggar S. et al. // Nat. Biotechnol. 2005. №23. Р.482-487.
5. Daniell H. // Biotechnol. J. 2006. №1. Р.1071-1079.
6. Palka-Santini M., Schwarz-Herzke B., Hosel M. et al. // Mol. Genet. Genomics. 2003. №270. Р.201-215.
7. Forsman A., Ushameckis D., Bindra A. et al. // Mol. Genet. Genomics. 2003. №270. Р.362-368.