№ 5, 2000 г.
© В.А.ВавилинАвтоколебания
в жидкофазных химических системахВ.А. Вавилин
Василий Александрович Вавилин, доктор физико-математических наук,
главный научный сотрудник Института водных проблем РАН.
Возникновение упорядоченных структур в однородной среде — одна из фундаментальных научных проблем, волнующая и широкого читателя, и научную общественность. Эволюционное развитие мира, первоначальное образование макромолекул и зарождение жизни — лишь некоторые из вечных вопросов науки. В открытых неравновесных системах выделяются два типа упорядоченного поведения: диссипативные структуры, которые образуются и сохраняются благодаря потоку энергии, проходящей через систему; автоволны, возникающие в пространстве с локальными источниками автоколебаний — незатухающих колебаний, характерных для нелинейных динамических систем.
В 2001 г. исполнится 50 лет открытия Б.П.Белоусовым автоколебательной химической реакции, благодаря которому появилась возможность наблюдать зарождение и исчезновение диссипативных структур и автоволн в модифицированной гомогенной химической системе.
Концентрационные колебания
Колебания в гомогенной жидкофазной химической системе в 1921 г. открыл У.Брей. При разложении перекиси водорода йодатом калия (t=25°С) он обнаружил периодическое выделение кислорода из системы, зафиксировав несколько периодов сильно затухающих колебаний [1]. Некоторые исследователи, ссылаясь на интенсивное газовыделение, высказывали сомнения в гомогенном характере этой реакции, поэтому существование колебательной реакции именно в гомогенной среде опыты Брея так и не доказали.
Интересно, что первую феноменологическую модель гомогенной химической реакции с затухающими колебаниями концентраций реагентов еще в 1910 г. предложил А.Лотка. Модифицировав ее, он получил незатухающие колебания [2]. В настоящее время это — известная модель Лотки—Вольтерра, которая описывает периодические изменения численности “жертвы” и “хищника” в экологических системах. В 30—40-е годы автоколебания в газофазных химических реакциях получили теоретическое и экспериментальное подтверждение. Тогда Д.А.Франк-Каменецкий показал, что модель Лотки можно применить для описания периодических процессов окисления высших углеводородов [3]. Для газофазных химических реакций Франк-Каменецкий ввел термин “термокинетические колебания”, т.е. химические колебания, связанные как с кинетикой реакций, так и сопровождающимися в ходе реакции температурными изменениями [4]. Видимо, термокинетические колебания нельзя считать строго гомогенными.

Борис Павлович Белоусов.
Фото 30-х годов.В 1955 г. И.Пригожин показал, что в открытой системе около стационарного состояния, достаточно удаленного от химического равновесия, возможны химические колебания [5]. Именно он обратил внимание западной научной общественности на работы советских исследователей.
Систематические исследования
Классическая теория колебаний с давних пор развивалась на физических объектах. Советскую школу теории колебаний основал Л.И.Мандельштам. Начиная с 1929 г. методы Ляпунова—Пуанкаре по устойчивости периодических решений применялись в изучении нелинейных колебаний. Ведущую роль в развитии этой области играла горьковская научная школа А.А.Андронова, а его монография, совместная с А.А.Виттом и С.Э.Хайкиным, стала настольной книгой нескольких поколений физиков [6]. В начале 60-х годов на кафедре биофизики физического факультета МГУ и позже в лаборатории физической биохимии Института биологической физики АН СССР работа Белоусова продолжилась. Тогда С.Э.Шноль предложил аспиранту А.М.Жаботинскому начать исследования механизма реакции Белоусова [7]. Интерес вызывало и сравнение механизмов реакций Белоусова и Брея. Перед Жаботинским и мной, студентом-дипломником кафедры биофизики физического факультета МГУ, стояла задача обнаружить колебания в системе Брея с помощью непрерывной спектрофотометрической регистрации концентрации йода.
Через полгода безуспешных попыток мы зарегистрировали такие колебания при относительно высокой температуре (60°С). Они происходили синхронно с колебаниями скорости выхода кислорода из системы и окислительно-восстановительного потенциала. Сейчас можно сказать, что нам сопутствовала удача: слишком узкой была в этой системе область существования колебаний и гораздо вероятнее — ее монотонное поведение. Между двумя гомогенными периодическими реакциями Брея и Белоусова сразу же возникла своего рода “конкуренция”. Тем не менее легкое воспроизведение результатов и красивые визуальные эффекты нашли у реакции Белоусова больше приверженцев, и она получила широкую известность (позднее ее назвали реакцией Белоусова—Жаботинского, а периодическую реакцию Брея — реакцией Брея—Либавского).
К настоящему времени реакция Белоусова—Жаботинского заняла достойное место в мировой науке. Она фактически стимулировала появление новой области науки, а экспериментальные работы инициировали развитие современной теории динамических систем. В 1988 г. на русском языке вышел перевод английского издания книги “Колебания и бегущие волны в химических системах” с наиболее полной сводкой результатов, полученных ведущими исследователями различных школ. Позднее, в 1991 г., Жаботинский повторил хронологическое изложение работ своей группы в первых номерах широко известного ныне американского журнала “Chaos”.
Динамика публикаций по колебательным реакциям в мировой литературе в XX в. Видно, что латентный период в исследованиях (до середины 60-х) сменился стремительным ростом после первых публикаций А.М.Жаботинского.В группе Жаботинского проводились как экспериментальные, так и теоретические исследования. М.Д. Корзухин доказал теорему о том, что в гомогенной химической системе можно получить любое наперед заданное во времени поведение концентраций реагентов [8]. Таким образом, достаточно абстрактную нелинейную модель, описывающую колебания, можно развернуть в кинетические уравнения, подчиняющиеся закону действующих масс, элементарности парных взаимодействий и пр. Основной идеей этой работы, инициированной А.М.Молчановым, было обращение метода квазистационарных концентраций. В итоге Корзухин с соавторами предложили первую модель колебательной реакции белоусовского типа. Такой подход, поддерживаемый математиками, далеко неоднозначно воспринимался химиками. Достаточно вспомнить разгоревшуюся зимой 1969 г. острую дискуссию о правомерности подобного подхода для химической кинетики на защите кандидатской диссертации Корзухина в Институте химической физики АН СССР. Лишь упоминание имени Пригожина, пропагандирующего работы Жаботинского, позволило разрядить обстановку.
В изучении механизма колебаний использовали и традиционный кинетический подход, когда экспериментальные работы сопровождаются анализом возможных схем химических реакций, записью уравнений химической кинетики и сопоставлением экспериментальных и теоретических результатов. Идя по традиционному кинетическому пути, мы экспериментально определили области колебаний в реакциях Брея и Белоусова, подробно изучили зависимость их характеристик от параметров системы, а также ключевые стадии этих реакций [9]. Оказалось, что в реакции Белоусова диапазон начальных концентраций реагентов, в котором происходят колебания, составляет два-три порядка, но для реакции Брея он менее одного.
В системе Белоусова в ходе колебаний реакция окисления церия (Ce3+) броматом калия (стадия I) чередуется с реакцией его восстановления (Ce4+) малоновой кислотой (стадия II). Переключателем, обеспечивающим смену реакций, служит концентрация бромид-иона (Br–). Исследование кинетики и стехиометрии автокаталитической стадии I позволили создать первую кинетическую схему реакции, в которой период индукции (лаг-фаза) в значительной мере зависит от равновесной концентрации Br– — сильного ингибитора стадии I. Источником Br– служат бромпроизводные малоновой кислоты. Стадия II индуцирует разложение бромпроизводных малоновой и уксусной кислот, с выделением Br–. Форма колебаний в закрытой системе определялась начальными концентрациями реагентов. Были зарегистрированы как квазигармонические, так и релаксационные колебания.
Ранее реакцию Белоусова проводили в закрытом реакционном сосуде, поэтому из-за расходования реагентов (бромата и малоновой кислоты) колебания затухали. Затем в проточном реакторе непрерывного перемешивания получили незатухающие колебания, что позволило изучать тонкие стороны механизма автоколебаний, в частности зависимость периода и амплитуды колебаний от интенсивности ультрафиолетового излучения. В таком реакторе был зарегистрирован и режим прерывистой генерации [10].
Пространственные эффекты
В первых своих работах Жаботинский для наблюдения химических волн начал применять в качестве реакционного сосуда трубку (одномерный реактор), используя церий как катализатор. Замена церия на катализаторы типа ферроина позволила изучать пространственное поведение периодической реакции в тонком слое раствора [11]. Идея использовать чашки Петри (как двумерный реактор) принадлежала П.В.Гулаку, тогда студенту-дипломнику кафедры биофизики биологического факультета МГУ. От физика-экспериментатора обычно требуется грамотно проводить соответствующие измерения, а у биолога более богатый полет фантазии. Она и подтолкнула применить для изучения колебаний классическую в микробиологии чашку Петри, которая оказалась чрезвычайно удобной для экспериментальных исследований автоволн.
Термин “автоволна” был введен Р.В.Хохловым. Автоволны характерны для возбудимых (активных) сред, в которых составляющие элементы могут находиться в одном из трех состояний: покоя, возбуждения и рефрактерности (затрудненной возбудимости). Пример одиночной волны — это распространение пламени. В 1938 г. Я.Б.Зельдович и Д.А.Франк-Каменецкий показали, что в однородной химической среде фронт горения движется с постоянной скоростью, не зависящей от начальных условий [12]. При этом горение соответствует состоянию возбуждения. За фронтом пламени движется зона рефрактерности, в которой все исходное вещество исчерпано и горение невозможно. В биологической активной среде (возбужденных нервных сетях, сердечных аритмиях и пр.) после прохождения волны идет процесс восстановления, приводящий к исходному состоянию покоя.
Первую математическую модель активной среды (сердечной мышцы) предложили в 1946 г. Н.Винер и А.Розенблют [13]. В 60-е годы И.М.Гельфанд и его ученики продолжили исследования активных сред. После переезда Института биофизики АН СССР в г.Пущино установились рабочие контакты между школой Гельфанда и группой Жаботинского.
Движение волны возбуждения в реакции Белоусова—Жаботинского, идущей в тонком слое раствора, сопровождается достаточно медленными (мм/мин) локальными изменениями цвета раствора — от красного к синему и наоборот. До исчерпания химических реагентов (бромата, малоновой кислоты) в чашке Петри может пройти до 100 отдельных автоволн. Перенос возбуждения от одного элемента среды к другому обусловлен диффузией реагентов. Выше уже говорилось о ключевой роли бромид-иона в реакции Белоусова. В распределенной системе возбуждение (автокаталитическая стадия I) подавляется выделяющимся ингибитором (Br–). Спустя некоторое время после уменьшения концентрации Br– система вновь готова к возбуждению. Волна движется по среде без затухания, сохраняя форму и амплитуду. В итоге экспериментально было подтверждено, что в активной среде более медленные ведущие центры подавляются [14]. В случае нескольких ведущих центров, благодаря эффекту синхронизации ритм всей среды навязывается наиболее быстрым из них. Были обнаружены и спиральные волны, названные
ревербераторами.
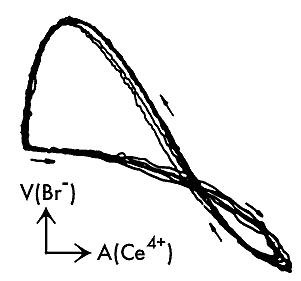
Предельные циклы типа восьмерок в периодической реакции Белоусова—Жаботинского. A (Ce4+) — светопоглощение, V (Br–) — потенциал бромсеребряного электрода.
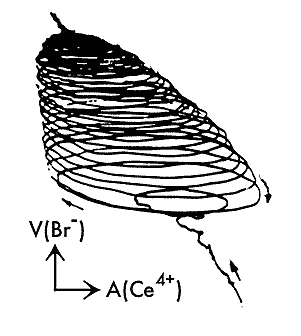
Пример эволюции колебательного режима в ходе периодической реакции Белоусова—Жаботинского.
Автокаталитическая реакция в растворе без перемешивания начинается с некоторых “горячих точек”. После накопления “критической массы” активных частиц (видимо, свободных радикалов BrO2) реакция значительно ускоряется при перемешивании раствора. На кафедре биофизики биологического факультета МГУ в ходе автокаталитической реакции была зарегистрирована хемилюминесценция, а в процессе распространения волны обнаружены характерные структуры — ячейки, языки и др. [15]. Сейчас можно сказать, что это были первые “диссипативные структуры”, выявленные в ходе автокаталитической химической реакции (тогда термин еще не был принят). Подобные структуры в однородной распределенной системе с диффузией, где идет автокаталитическая реакция, А.Тьюринг предсказал еще в 1952 г., а сам термин “диссипативная структура” предложил Пригожин.
Возникновение ведущих центров в реакции Белоусова—Жаботинского. Интервалы между кадрами составляют 30 с. (Zaikin A.N., Zhabotinskii A.M., 1970)Вместо эпилога
С начала активной работы группа Жаботинского не раз демонстрировала реакцию Белоусова видным советским ученым — И.Е.Тамму, Н.Н.Семенову, В.А.Энгельгардту и др. И хотя они, интуитивно предчувствуя новые научные результаты, понимали важность этих исследований, “колебательная химия” не стала профилирующим направлением в Институте биологической физики АН СССР. Нам приходилось работать в самых различных институтах. Фактически именно это, как и некоторые внутренние разногласия, привели к тому, что группа Жаботинского в 1969 г. распалась. После 1972 г. лидерство наших ученых в этой области стало утрачиваться. Появились новые имена и возникли новые научные школы. Они зачастую воспроизводили наши старые результаты, хотя и без соответствующих ссылок на оригинальные работы. Ведь основные работы группы были опубликованы в отечественной литературе.
Мультиграфы соавторства и соответствующие научные школы по периодическим химическим реакциям на 1972 г. Светлые кружки — число публикаций от 1 до 5, цветные — от 6 до 16, черные — более 16; пунктиры (число соавторов) — один-два, цветные линии— от 3 до 5, черные — более 5. (Бургер М., Буйдошо Э., 1988).В истории, в том числе и истории науки, не бывает сослагательных наклонений. Сейчас можно только безнадежно гадать, что было бы, если бы биохимик Шноль, работавший в радиационной медицине, не натолкнулся на работу Белоусова? Как стали бы развиваться исследования периодических процессов, если бы Жаботинский не продолжил работы Белоусова? И наконец, как бы развивалась колебательная химия в Академии наук СССР, если бы получила достойную своевременную поддержку? В настоящее время сложные вопросы динамики и самоорганизации неравновесных систем изучают в самых разных областях естествознания.Литература
1 Bray W.C. // J. Am. Chem. Soc. 1921. V. 43. P. 1262.
2 Lotka A.J. // J. Phys. Chem. 1910. V. 14. P. 271.
3 Франк-Каменецкий Д.А. // ДАН СССР. 1939. Т. 25. С. 672.
4 Франк-Каменецкий Д.А. // Диффузия и теплопередача в химической кинетике. М.; Л., 1947.
5 Пригожин И. Введение в термодинамику необратимых процессов. М., 1960.
6 Андронов А.А., Витт А.А., Хайкин С.Э. Теория колебаний. М., 1959.
7 Жаботинский А.М. // Биофизика. 1964. Т. 9. С. 306; Он же. // ДАН СССР. 1964. Т. 157. С. 392.
8 Корзухин М.Д. // Колебательные процессы в биол. и химич. системах / Ред. Г.М.Франк. М., 1967. C. 231.
9 Вавилин В.А., Жаботинский А.М. // Кинетика и катализ. 1969. Т.10. С.83; Вавилин В.А., Заикин А.Н. // Там же. 1971. Т. 12. С. 309; Vavilin V.A., Zhabotinsky A.M., Zaikin A.N. Biological Chemical Oscillators / Ed. B.Chance et al. Paper Contrib. Conference 1968—1969. N.Y., 1973. P. 71.
10 Вавилин В.А., Жаботинский А.М., Заикин А.Н. // Журн. физ. химии. 1968. Т. 42. С. 3091.
11 Вавилин В.А., Гулак П.В., Жаботинский А.М., Заикин А.Н. // Изв. АН СССР. Сер. хим. 1969. Т. 11. С. 2618.
12 Зельдович Я.Б., Франк-Каменецкий Д.А. // Журн. физ. химии. 1938. Т. 12. С. 100.
13 Wiener N., Rosenblueth A. // Arch. Inst. Cardiol. Mexico. 1946. V. 16. P. 205.
14 Zaikin A.N., Zhabotinskii A.M. // Nature. 1970. V. 225. P. 535.