№ 4, 2003 г.
© Р.В. Вартанян
Проблемы цитомегаловирусной инфекции
Р.В.Вартанян
Раиса Викторовна Вартанян, канд. мед. наук, ст. научн. сотр. клинического отдела
Научно-исследовательского института вирусологии им.Д.И.Ивановского РАМН.За последние 25 лет выявлено более 30 видов новых инфекционных заболеваний, среди которых уже известные и хорошо контролируемые болезни получили широкое распространение. В этом ряду особое место занимает цитомегаловирусная инфекция (ЦМВИ, цитомегалия), которая вызывается вирусом, относящимся к семейству герпесов. Несмотря на то что история этой болезни насчитывает более 100 лет, наши знания о ее значении в патологии детей и взрослых далеко не полные. По определению Всемирной организации здравоохранения (ВОЗ), цитомегалия - новая таинственная инфекция.
27 июня 1881 г. на заседании Нижнерейнского общества врачей немецкий патологоанатом Х.Риберт впервые описал гипертрофию почечных канальцев при нефрите у мертворожденного младенца с врожденным сифилисом. Обнаружив в эпителии почечных канальцев необычные гигантские клетки с ядерными включениями, он предположил, что их возникновение обусловлено специфической инфекцией. Позднее, в 1904 г., он описал подобные клетки в различных органах новорожденных детей [1].
В 1921 г. Е.Гоодпастун и Ф.Талбот впервые высказали мнение, что гигантские клетки образуются из нормальных эпителиальных клеток в результате хронического воспаления, и назвали их цитомегалами, а состояния, при которых они встречаются, - детской цитомегалией. Спустя четыре года были описаны такие же клетки в печени и кишечнике умершего тридцатилетнего мужчины, страдавшего язвенным колитом и абсцессом печени.
В 1926 г. Р.Коле и А.Куттнер доказали вирусную природу цитомегалии у животных, выделив вирус из слюнных желез грызунов и проведя его семь пассажей. А спустя шесть лет К.Фарбер и К.Вольбах предположили, что цитомегалия у детей также вирусного происхождения. Только в 1956 г. А.Смит и В.Рове независимо друг от друга изолировали цитомегаловирус (ЦМВ) из ткани почек и подчелюстной железы. Через год А.Веллер с сотрудниками обнаружили этот вирус в моче у детей с клиническими симптомами цитомегалии и рекомендовали использовать свой метод для диагностики. В нашей стране первые работы, посвященные этому заболеванию, относятся к 1958 г., а в 1961 г. вирус был выделен из мочи, слюны и молока кормящих матерей. В 1967 г. ЦМВИ вошла как нозологическая единица в международную номенклатуру ВОЗ.
Известно, что источник инфекции - человек, носитель вируса или больной острой формой. В большинстве случаев цитомегалия протекает латентно, но становится опасной при беременности, в перинатальном периоде, у детей раннего возраста, а также при иммунодефиците. После первичного инфицирования вирус не выводится из организма хозяина, а циркулирует в нем всю жизнь. Отсюда и довольно высокая (до 100%) его выявляемость в отдельных популяциях.
Семейство Herpes viridae, к которому принадлежит цитомегаловирус (HHV5, или Cytomegalovirus), объединяет около 70 вирусов и включает три подсемейства: Alphaherpesvirinal, куда входят вирусы простого герпеса человека, ветряной оспы и опоясывающего герпеса; Gammaherpesvirinal, к которому относится вирус Эпштейн-Барра; Bethaherpesvirinal, включающее вирус цитомегалии человека и мышей.
Все вирионы герпеса имеют примерно одинаковый размер (120-150 нм в диаметре) и сложное строение. Сердцевина, заключенная в белковый капсид, содержит ДНК. Геном вируса представляет линейная двунитчатая ДНК с молекулярной массой 80-150·106. Капсид, состоящий из 162 мономеров, окружен липопротеидной оболочкой с шипиками на поверхности. Между капсидом и оболочкой расположен слой, размер которого значительно варьирует у разных вирусов. Молекулярная масса вирионов более 10·108.
Пять гликопротеидов (oA, oB, oC, oD и oE) расположены на наружной поверхности липопротеидной оболочки. Ряд вирусных антигенов связан и с внутренними белками, и с гликопротеидами. Основные иммуногены - гликопротеиды (gB, gC, gD), которые индуцируют синтез антител, нейтрализующих вирус, и клеточный иммунный ответ организма.
Вирусы термолабильны, чувствительны к эфиру, детергентам, инактивируются при pH<4.0 и хорошо сохраняются при комнатной температуре.
В клетку проникают путем рецепторного эндоцитоза. В результате слияния плазматической и вирусной мембран и стенки эндоцитарной вакуоли липопротеидная мембрана вируса разрушается и нуклеокапсид достигает клеточного ядра.
Вирус активирует синтез ряда клеточных ферментов, а также двух собственных. В инфицированных клетках образуется большое количество вирусспецифических белков, которые превращаются в структурные вирусные белки. Капсидные белки, проникшие в клеточное ядро, ассоциируются с вновь синтезированными геномами. Нуклеокапсиды соединяются с модифицированными участками ядерной мембраны, и вирусные частицы отпочковываются в околоядерное пространство. Затем они транспортируются в аппарат Гольджи и оттуда выносятся на поверхность плазматической мембраны [2]. Для цитомегаловируса характерна медленная репликация, низкая вирулентность и способность подавлять клеточный иммунитет. Различают три стадии репликации.

Схема строения цитомегаловируса.
Очень ранняя фаза продолжается первые 24 ч после инфицирования. В этот период образуются протеины, обеспечивающие начало вирусной репликации. Антигены аккумулируются в клеточном ядре и синтезируются в течение вирусной репликации.
Ранняя фаза определяется от начала синтеза вирусной ДНК (спустя 2-4 ч от инфицирования) и длится 24-72 ч. На этом этапе возникают ферменты, необходимые для размножения ДНК, - ДНК-полимеразы.
Поздняя фаза начинается спустя 24-48 ч после инфицирования и заканчивается гибелью клетки. Вирус строится в ядре клетки, а затем вымывается через цитоплазму к поверхности клетки.
На электронно-микроскопических снимках цитоплазматические и внутриядерные вирусные частицы имеют различное строение. Чаще всего в ядрах вирусных клеток видны частицы в виде колечек, реже - кольцевидные двухконтурные частицы. Встречаются электронно-плотные образования округлой, овальной форм различной величины, часто в виде скоплений.
Морфологии цитомегаловирусных поражений посвящено много работ как в нашей стране, так и за рубежом. Основной, наиболее типичный признак - появление гигантских (диаметром 25-40 мкм) клеток с ядерными и цитоплазматическими включениями, похожих на совиный глаз. Они имеют типичную структуру, разнообразную форму и размеры, зависящие от стадии метаморфоза. Обнаружение подобных клеток в моче, слюне и других выделениях позволяют поставить диагноз цитомегалии.
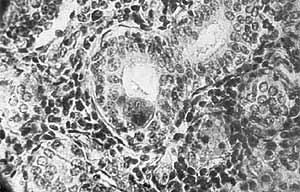
Цитомегаловирусные включения, напоминающие совиный глаз,
в почечном канальце (слева) и в протоках слюнной железы.
Увел. 320.Наиболее часто цитомегалы встречаются в слюнных железах, почках, печени, поджелудочной железе, кишечнике, надпочечниках, щитовидной железе, мозге и легких. Поскольку вирус выделяется с мочой, носоглоточным секретом, слюной, спермой, молоком, кровью, заражение соответственно может быть перинатальным, трансплацентарным, через грудное молоко, трансфузию крови и ее препаратов, половым и контактно-бытовым. Когда-то из-за частого обнаружения в слюне пациентов цитомегаловирусных включений даже существовал термин “болезнь поцелуев”. Распространенность этой инфекции зависит от социально-экономических и гигиенических условий жизни. У лиц, имеющих более низкий уровень жизни и проживающих в условиях скученности, антитела к цитомегаловирусу определяются чаще.
Механизм развития заболевания зависит от пути передачи вируса, его особенностей, а также от состояния организма в момент инфицирования, и в первую очередь иммунитета. Первичная репродукция вируса вероятнее всего происходит в клетках ретикулоэндотелиальной системы и эндотелия в результате его непосредственного перехода из одной клетки в другую.
Отдельные специалисты считают, что вирус попадает в слюнные железы, где может длительно циркулировать, проходя своеобразную тренировку вирулентности. Эпителиальные клетки слюнных желез - хорошая питательная среда для вируса, в которой его активность, а значит, и способность проникать в клетки, достаточно высоки. При носительстве или латентной инфекции, когда подавлен иммунитет (вирусные инфекции, гиповитаминозы, облучение, беременность), вирус реактивируется и может привести к активному процессу. В настоящее время активно изучается роль иммунной системы в патогенезе заболевания, в основном клеточного звена иммунитета.
Многообразие клинических форм этой инфекции обусловлено способностью вируса поражать различные ткани и органы. Это дало повод сравнивать цитомегаловирус с многоликим Протеем - мифологическим чудовищем, принимающим облик различных существ.
Вспомним, что впервые цитомегалия была обнаружена у новорожденного. И сегодня эта инфекция особое значение имеет для беременных и детей, среди которых она распространяется из-за увеличения числа инфицированных женщин. Вирус в основном попадает к детям от матерей-носителей. В ходе беременности плод получает его через плаценту. Во время родов источником может быть инфицированная шейка матки. Наиболее опасны для плода первые 20 недель беременности при первичном заражении женщины. Инфицирование в ранние сроки беременности приводит к мертворождению, выкидышам и различным уродствам. Заражение во второй половине беременности или реактивация хронической цитомегалии вызывает внутриутробное поражение различных органов и систем у плода. После родов важную роль в передаче инфекции играет грудное вскармливание. У 8-10% детей, рожденных от матерей с первичной цитомегалией, имеются клинические признаки - гепатоспленомегалия, гидроцефалия, микроцефалия, тромбоцитопения, петехии, гепатит. Спустя несколько лет после заражения у 5-15% детей может возникнуть слепота, глухота, умственная отсталость, т.е. дети с такими расстройствами становятся инвалидами [3, 4].
Наиболее часто страдает печень, при этом гепатит протекает в безжелтушной и желтушной форме. У новорожденных цитомегалы находят в эпителии желчных протоков, в капиллярах и реже в паренхиме.
В головном мозге в результате инфекции развивается гидроцефалия или микроцефалия. Инфицированию, особенно у новорожденных, подвергаются нервные клетки и глия [5]. При УЗИ выявляют кисты, хореоретинит с атрофией зрительного нерва, нередко приводящий к слепоте.
При поражении желудочно-кишечного тракта возникает диспептический синдром, энтероколит, ведущий к дистрофии. Особенно часто ЦМВ-антиген выявляется в клетках пищевода, тонкой и толстой кишке, в прямой кишке.
Когда вирус проникает в нижние дыхательные пути, картина характеризуется появлением бронхита, бронхиолита и интерстициальной пневмонии.
Цитомегалия способствует возникновению миокардитов, васкулопатий, атеросклероза [4]. Постоянные носители или резервуары вируса - больные СПИДом, которые и распространяют инфекцию [6]. Высокий риск заражения отмечен также для онкологических больных, проходящих курс агрессивной химиотерапии.
В настоящее время ведется поиск новых локализаций цитомегаловируса и генеза самого заболевания. Как довольно часто бывает, прогресс в одной области создает проблемы в смежных областях. Так, достижения трансплантологии породили новые проблемы в отношении вирусных заболеваний, сопровождающих пересадку органов. Ведущим инфекционным фактором в трансплантологии считается цитомегаловирус. После пересадки различных органов риск заражения резко возрастает (от 69 до 92%) и зависит от иммунного статуса реципиента (пациента), донора и от наличия (или отсутствия) профилактики инфекции. Особенно отчетливо такая тенденция проявляется при трансплантации костного мозга: очень часто наблюдается тяжелая пневмония, нередко заканчивающаяся летальным исходом. В то же время успехи реконструктивной хирургии одновременно стимулируют и поиск новых диагностических технологий и терапевтические подходы к цитомегаловирусной инфекции.
В отличие от других вирусных заболеваний клинический диагноз цитомегалии нельзя установить без соответствующего лабораторного подтверждения. В настоящее время существует целый ряд лабораторных методов. Сравнительно простым и доступным считается присутствие в осадках слюны и мочи характерных внутриядерных включений. Для клинициста более значимы вирусологические методы, основанные на выделении вируса или его белковых антигенов в культуре ткани, зараженной материалами от больных. Наряду с этим используют также и иммунологические тесты - определение специфических антител различных классов. Так, наличие IgM антител свидетельствует об острой форме инфекции или ее реактивации, IgG - о латентной или хронической форме.
В последнее время для обнаружения вирусной ДНК широко применяются молекулярно-биологические методы: молекулярная гибридизация, полимеразная цепная реакция. Помимо специфических лабораторных данных, необходимо учитывать клинические проявления, анамнез и результаты других методов исследования (УЗИ, биохимии крови, состояния Т-клеточного иммунитета и др.).
Несмотря на то что цитомегаловирусную инфекцию изучают более 100 лет, единой классификации этого заболевания нет ни в нашей стране, ни за рубежом. В повседневной практике мы используем рабочий вариант, предложенный сотрудниками Института вирусологии им.Д.И.Ивановского (с учетом срока и механизма инфицирования): врожденная и приобретенная ЦМВИ, острая и хроническая форма, реактивация инфекции, латентное течение (табл.). Правомерная интерпретация лабораторных показателей, определение формы и типа течения болезни способствуют выбору оптимальной терапии [7].
Эффективное лечение цитомегалии сопряжено с определенными трудностями как в диагностике, так и в выборе медикаментов. В арсенале врачей сегодня имеются несколько терапевтических средств - антивирусные препараты (ганцикловир, фоскарнет, валганцикловир) и человеческие иммуноглобулины, оказывающие антиинфекционное и иммуномодулирующее действие.
Ганцикловир подавляет синтез ДНК вируса при активной фазе болезни. Показания для его применения очень строгие: наличие вируса в культуре клеток, определение цитомегаловирусного антигена в крови, моче или методом молекулярной гибридизации ДНК цитомегаловируса. Если анализы не подтверждают активную инфекцию, то ставить диагноз только по присутствию антител к ЦМВ или по обнаружению вирусных включений в биоптатах нужно осторожно.
Специфические анти-ЦМВ-иммуноглобулины (Цитотект, Мегалотект) в отличие от противовирусных препаратов способствуют нейтрализации свободного и внутриклеточного вируса, тем самым предотвращая инфицирование других клеток.
Однако и противовирусные препараты, и иммуноглобулин Цитотект весьма дорогостоящие, и их применение в наших условиях проблематично. Для нейтрализации ЦМВ-антигена и ограничения размножения вируса в организме мы используем отечественный нормальный человеческий иммуноглобулин для внутримышечного введения (титр антител к ЦМВ в иммуноферментном анализе 1:640 000).
Многолетние наблюдения за пациентами, инфицированными цитомегаловирусом, выявили дисбаланс иммунокомпетентных клеток (снижение субпопуляций хелперов-индукторов и увеличение супрессоров-киллеров, снижение соотношений хелперов-супрессоров <1.0 и активности естественных киллеров). Полученные данные о нарушениях Т-клеточного иммунитета при цитомегалии послужили основанием для применения иммуномодуляторов (тактивин, рибомунил и т.д.), т.е. возникли предпосылки для патогенетической терапии. В ходе поиска наиболее эффективного лечения принималась во внимание слабая продукция интерферона, поэтому появилась необходимость в препаратах интерферонового ряда (виферон) или индукторов интерферона.
Накопленный за много лет опыт (более 700 инфицированных пациентов) позволил разработать несколько терапевтических режимов в зависимости от клинических проявлений и тяжести заболевания [8]. При тяжелых формах (прогрессирующей гидроцефалии, энцефалопатии, фетального гепатита, лихорадки, иммунодефицитного состояния), представляющих угрозу для жизни пациентов, назначали ганцикловир. В результате лечения активность вирусной инфекции подавлялась.
Больным с реактивированной формой назначали отечественный нормальный иммуноглобулин с высоким титром анти-ЦМВ-IgG. Терапевтический эффект наблюдали по отсутствию антигена цитомегаловируса в крови, моче и по нормализации температуры. Однако у 20% больных после лечения иммуноглобулином сохранялись и антиген ЦМВ, и анти-ЦМВ-IgM, свидетельствующие об остроте процесса. В этих случаях повторяли курс иммуноглобулина в сочетании с тактивином, что приводило к исчезновению остаточной клинической симптоматики и признаков острой инфекции.
В ходе поиска наиболее эффективного лечения цитомегалии возникла необходимость в комбинированной терапии, т.е. в одновременном использовании противоцитомегаловирусного иммуноглобулина и интерферонов (виферона, неовира, циклоферона). В результате такого лечения у подавляющего большинства больных (82%) признаки острой инфекции исчезали.
Сложности диагностики и лечения обусловлены многофакторностью цитомегалии, и решение этих задач зависит от мастерства врачей и медицинского персонала. Опыт последнего 20-летия свидетельствует, что в отдельных случаях недостаточная компетентность врачей приводит к диагностическим ошибкам, следовательно, к неправильному лечению, а нередко - к так называемой дорогостоящей несистематизированной политерапии. Проблема усложняется и тем, что в последние годы появилось на рынке много названий препаратов и модуляторов, которые не совсем объективно рекламируются различными зарубежными фирмами и компаниями.
Состояние здоровья детей, снижение рождаемости и резкое увеличение инфицированных цитомегаловирусом - все это требует глубоких медико-биологических исследований, дальнейшего улучшения лечебно-диагностической работы, совершенствования здравоохранения, и особенно педиатрических служб. Сегодня диагностика и терапия цитомегалии составляют приоритетный раздел современной науки и практики. Учитывая характер и распространенность этого заболевания в природе, данная проблема важна не только для медиков, но и для специалистов, участвующих в разработке профилактики и поиске химических соединений, применяемых в терапии цитомегаловирусной инфекции.
Литература
1. Демидова С.А., Семенова Е.И., Жданов В.М. и др. Цитомегаловирусная инфекция человека. М., 1976.
2. Букринская А.Т. // Вирусология. 1986. С.198-200.
3. Фарбер Н.А., Кетиладзе Е.С. // Сов. медицина. 1982. №2. С.68-71.
4. Ершов Ф.И., Касьянова Н.В. // Инфекции и антимикробная терапия. 2002. Т.4. №4. С.116-119.
5. Лещинская Е.В., Мартыненко И.Н., Демидова С.А. и др. // Вопр. охраны материнства и детства. 1985. №5. С.610-615.
6. Fuomcissi D., Tosti A., Baldelli F. et al. // AIDS. 1997. V.11. P.1341-1345.
7. Чешик С.Г., Малышев Н.А., Досев С.Д. и др. // Рос. вестн. перинатол. и педиатрии. 1995. Т.40. №2. С.15-18.
8. Вартанян Р.В. // Врач. 2002. №3. С.26-28.