№ 3, 2007 г.
© Киселев Ф.Л., Боринская С.А.
Вакцина против рака - первые успехи Ф.Л. Киселев, С.А. Боринская
Федор Львович Киселев, член-корреспондент РАМН, профессор, доктор биологических наук,
руководитель отдела трансформирующих генов опухолей НИИ канцерогенеза Онкологического научного центра им.Н.Н.Блохина РАМН.Светлана Александровна Боринская, кандидат биологических наук,
старший научный сотрудник лаборатории анализа генома Института общей генетики им.Н.И.Вавилова.Все хотят жить долго, но никто не хочет быть старым
Джонатан Свифт
Продолжительность жизни россиян конца XIX в. не превышала в среднем 30 - 40 лет и достигла 60-летнего рубежа лишь во второй половине XX в., в послевоенное время, когда настала эра антибиотиков и всеобщей вакцинации. Увеличение продолжительности жизни связано с изменением структуры смертности. Раньше жизни людей уносили преимущественно эпидемии и голод, сейчас на первые места вышли заболевания сердечно-сосудистой системы и рак. Возрастание в развитых странах частоты этих заболеваний, характерных для людей более старшего возраста, означает, что все большая часть населения не умирает в молодости от дифтерии, оспы, туберкулеза, других инфекций или так называемых внешних причин и доживает до того возраста, когда сердечно-сосудистые или онкологические заболевания успевают развиться [1]. Отодвинуть рубеж их проявления, найти эффективные методы профилактики и лечения можно, если понять причины этих болезней, особенности их течения и выявить звенья в цепи событий, ведущих к развитию заболевания, на которые нужно воздействовать.
На этом пути одним из наиболее впечатляющих успехов последнего десятилетия стало создание вакцины против рака шейки матки, занимающего после рака молочной железы второе место по распространенности среди онкозаболеваний у женщин [2]. Вакцина, обладающая почти 100%-й эффективностью, может уберечь от болезни и спасти жизни сотен тысяч женщин.
В истории создания этой вакцины сплелись новейшие молекулярно-генетические технологии, эпидемиологические наблюдения более чем столетнего периода, взлеты и заблуждения научной мысли, человеческие судьбы и патентные баталии. О научных исследованиях, выявивших клеточные и молекулярные механизмы развития болезни и указавших путь к избавлению от нее, и пойдет речь в этой статье.
От Гиппократа к ДНК
Раковые заболевания были известны в глубокой древности, их описание можно найти у отца медицины Гиппократа (460-370 гг. до н.э.). Ему же приписывают и сам термин “рак” - Гиппократ назвал карциномами некоторые виды опухолей из-за их крабовидной формы (cancer - краб). Причиной рака он считал скопление в отдельных частях тела “черной желчи”, одного из четырех флюидов, нарушение равновесия которых, по представлениям того времени, вело к проявлению заболеваний. Теории флюидов придерживался и знаменитый Гален (129-201 гг.).
Гиппократ пытался лечить рак шейки матки препаратами чеснока, а вот Гален считал пациента неизлечимым, если ему был поставлен диагноз рак. Несмотря на успехи медицины, эта точка зрения оказалась очень живучей. Даже сегодня некоторые люди считают рак неизлечимым и откладывают посещение врача до того, пока действительно не станет слишком поздно. Но возможность вылечиться вполне реальна, особенно на ранних стадиях болезни.
Наблюдения, способствовавшие раскрытию природы раковой болезни, накапливались по мере развития медицины. В XVIII в. итальянский врач Барнардино Рамаззини отметил отсутствие рака шейки матки и относительно высокую частоту рака молочной железы у монахинь, и заинтересовался, не связан ли первый с обетом безбрачия, а второй - с ношением тесной одежды. Лондонский хирург Персиваль Потт описал заболевания раком у трубочистов, возникающее из-за воздействия сажи на кожу, а его соотечественник Джон Хилл сообщил об опасности употребления табака [3]. Позднее вещества, вызывающие развитие рака, назвали канцерогенами. Когда выяснилось, что опухоли можно получать и у экспериментальных животных (мышей, собак), каменноугольную смолу использовали в первых экспериментах по индуцированному канцерогенезу.
В XIX в. Роберт Вирхов заложил научные основы современного патологического исследования раковых тканей. Это помогло выяснить характер разрушений и изменений раковых клеток, но не привело к пониманию их причин. Считалось, что рак вызывается травмами, хроническим раздражением или паразитами.
В XX в. через несколько лет после открытия рентгеновских лучей их стали применять для диагностики и лечения рака; тогда же обнаружили канцерогенный эффект облучения. Прорыв в понимании механизмов канцерогенеза обеспечило открытие ДНК и закономерностей ее изменений - мутаций. К этому времени уже было ясно, что существует множество причин, вызывающих рак (радиация, химические воздействия канцерогенных веществ, некоторые вирусы), и имеются семейные формы рака, предрасположенность к которым наследуется. Все эти причины приводили к нарушению работы генетического аппарата клетки.
Были найдены и изучены гены, которые контролируют деление клетки. Нормальные клетки человека в лабораторных условиях после 30-50 делений погибают, хотя некоторые клетки, например стволовые, таких ограничений не имеют. Однако в некоторых условиях они могут приобрести способность к неограниченному делению, давая так называемые иммортализованные (“бессмертные”) линии. Такая иммортализация и есть первый этап превращения клетки в злокачественную.
Второй этап называется малигнизацией (злокачественным перерождением). Раковые клетки перестают реагировать на контакты со своими соседями, в отличие от нормальных (которые прекращают расти и делиться, заполнив предназначенное для них место). Пусковой кнопкой, переключающей программу развития с ограниченного размножения на безудержное деление, служит нарушение работы генов, контролирующих клеточный цикл. В отдельных клетках этот сбой может быть наследственным (при семейных формах рака) либо вызваться внешними причинами - теми самыми, которые были перечислены выше: облучением, воздействием канцерогенов и вирусными инфекциями. Наиболее распространены спонтанные раки, тогда как семейные формы составляют менее 15%, а раки вирусной природы - около 15-20% [2].
В разных видах опухолей “поломки” обнаруживаются в разных генах. В большинстве случаев остается неизвестным, какой именно ген “сбился с ритма” и каковы молекулярные механизмы нарушений, ведущих к развитию раковой опухоли. Но если ген, запустивший процесс бесконечного деления, внесен в клетку вирусом, то найти его гораздо легче. Ведь в отличие от десятков тысяч генов в клетке человека, в вирусном геноме их немного, и исследовать эти гены намного проще.
Изучение молекулярных механизмов вирусного канцерогенеза позволило не только понять возникновение отдельных раковых заболеваний, но и прояснило общую картину взаимодействия разных генов в переключении программ жизнедеятельности клетки.
Роль вирусов в онкогенезе
Первые гипотезы о вирусной природе рака высказывались еще в начале ХХ в. рядом ученых, в том числе и И.И.Мечниковым. Представления о раке как болезни генома и о вирусах как инициаторах развития опухоли сформулировал Л.А.Зильбер на основе экспериментов по перевиванию опухолей у животных. Эти опыты он проводил в 1940-1944 гг., находясь в тюрьме и выменивая у заключенных необходимых для опытов крыс и мышей на табак.
В настоящее время известно несколько вирусов, способных вызывать раковые заболевания у человека. Все индуцированные вирусами злокачественные опухоли развиваются после длительного латентного периода, обычно от 5 до 30 и более лет. Это рак печени, вызываемый вирусами гепатита B и С, рак носоглотки и лимфома Беркитта (вирус Эпстайна-Барр), саркома Капоши (вирус герпеса, тип 8), раки шейки матки, вульвы, пениса и носоглотки (определенные типы вируса папилломы человека) и некоторые другие онкозаболевания. На долю вируса папилломы (HPV, Human papilloma virus) приходится около 10% всех случаев заболевания раком. Ведущую роль в папилломавирусных онкозаболеваниях занимает рак шейки матки. У женщин эта форма рака вторая по распространенности после рака молочной железы (рис.1); как правило, поражает молодых женщин (от 22 до 44 лет), и средняя “потеря жизни” при этом составляет 26 лет, в то время как для больных раком молочных желез и яичников - 19 и 17 лет соответственно [2].
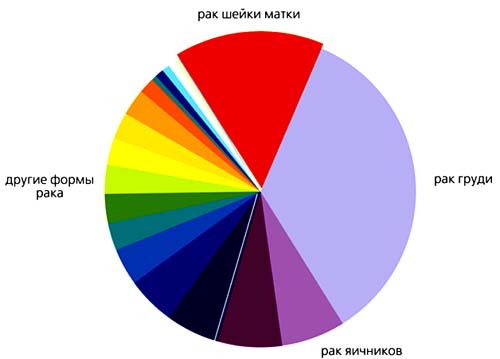
Рис. 1. Заболеваемость различными формами рака среди европейских женщин (возраст 15-44 года) [2].
Доказательства вирусной природы этого заболевания накапливались постепенно. В 1970-х годах появились предположения о связи вируса герпеса с раком шейки матки, однако позднее выяснилось, что это просто совпадение, обусловленное одинаковым путем передачи вирусов при сексуальных контактах. Затем под подозрения попали вирусы папиллом, но окончательно их роль в развитии рака шейки матки была доказана лишь с появлением новых методов диагностики, основанных на выявлении вирусной ДНК. При папилломавирусной инфекции вирусные частицы не всегда присутствуют в клетке, а вирусную ДНК (интегрированную в клеточный геном или в свободном виде) можно обнаружить с помощью полимеразной цепной реакции (ПЦР). Применение этого высокочувствительного метода позволило доказать, что почти при всех раках и предраковых поражениях шейки матки в измененных клетках присутствует вирусная ДНК, а опухоль состоит из потомков одной перерожденной клетки, представляя собой так называемый клон.
У человека известно более 100 различных типов папилломавирусов [4]. Во многих случаях инфекция проходит бессимптомно. Большинство вирусов вызывают доброкачественные разрастания кожи (бородавки), но некоторые инициируют злокачественное перерождение клеток эпителия слизистой оболочки. В середине 80-х годов исследования группы немецких специалистов под руководством Харальда цур Хаузена убедительно показали, что при раках шейки матки выявляются два типа HPV (16 и 18), в то время как при доброкачественных поражениях (кондиломах) в основном присутствуют HPV другого типа (6 и 11) [5]. Позже доказательства роли вируса в развитии рака шейки матки были получены в многочисленных исследованиях, а список вирусов “высокого” риска был пополнен (тип 31, 45 и другие), но именно 16 и 18 типы оказались наиболее частой причиной рака. В России на их долю приходится около 90% всех исследованных случаев рака шейки матки. Так как вирус передается почти исключительно при половых контактах, данный вид рака можно рассматривать как инфекцию, передающуюся половым путем.
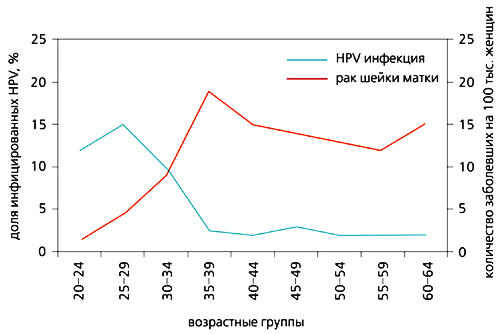
Рис. 2. Уровень инфицированности папилломавирусом и заболеваемость раком шейки матки
у женщин разного возраста среди обследованных 3752 женщин [6].Отнюдь не во всех случаях инфицирования возникает заболевание. Согласно различным оценкам, до 75% сексуально активных взрослых хотя бы раз в жизни инфицируются генитальными папилломавирусами. Больше всего это относится к молодым людям в возрасте 20-24 лет (рис.2) [6]. Присутствие вируса необходимо, но недостаточно для инициации канцерогенеза. Лишь у небольшой части женщин (1-3%), зараженных папилломавирусами группы высокого риска, развиваются злокачественные изменения. В мире число случаев рака шейки матки составляет около 450 тыс., и 200 тыс. женщин ежегодно умирают от этого заболевания. Другие формы аногенитального рака (пениса, вульвы, вагины, ануса), ассоциированные с папилломавирусами, встречаются на порядок реже [7].
В большинстве случае HPV-инфекция длится 6-12 мес и проходит без явных клинических проявлений. В трети случаев вирусную ДНК можно выявить более чем через год и в 10% - более чем через два года. На продолжительность поддержания инфекции влияют возраст, тип HPV (вирусы высокого риска персистируют дольше) и нарушение функций иммунной системы. Не исключено, что в некоторых случаях при полном исчезновении вирусной ДНК с поверхности слизистой она может сохраняться в скрытом состоянии в более глубоких слоях эпителия и впоследствии приводить к реактивации инфекции.
При HPV-инфекции шейки матки вирусная ДНК обнаружена не только в злокачественных опухолях (карциномах), но и в предраковых поражениях слизистой. Это говорит о том, что вирус действительно инициирует опухолевый процесс, в развитии которого важная роль принадлежит изменениям в работе клеточных генов.

Рис. 3. Стадии развития папилломавирусной инфекции [8].
В ранних поражениях шейки матки - так называемых интраэпителиальных дисплазиях стадии I (рис.3) - могут быть выявлены HPV как низкого, так и высокого риска [8]. Определение типа вируса имеет принципиальное значение для тактики последующего наблюдения за этими больными - при наличии вирусов низкого риска срок повторного обследования можно продлевать до полугода.
Факторами риска развития опухоли при папилломавирусной инфекции служат продолжительность персистирования вируса, снижение клеточного иммунитета, гормональные воздействия (аборт, беременность, прием гормональных контрацептивов и др.), курение, неправильное питание (дефицит фолиевой кислоты), частая смена партнеров, сопутствующие урогенитальные инфекции (например, хламидийная или герпетическая), а также индивидуальные генетические особенности.
Взаимодействие вируса и клетки
Вирус папилломы - довольно мелкий, его двунитевая кольцевая ДНК заключена в белковую оболочку - капсид (рис.4). В геноме вируса (размером 8000 пар нуклеотидов) шесть генов, обеспечивающих на ранних этапах его жизненного цикла взаимодействия с клеткой-хозяином и репликацию вирусной ДНК, и еще два гена, кодирующих белки капсида. Проникая в клетку, вирус использует клеточные системы для получения собственных белков. В первую очередь синтезируются белки, необходимые для поддержания и репликации вирусной ДНК. Эти гены обозначаются буквой Е (от англ. early - ранний). После наработки ДНК включаются “поздние” (late) гены L1 и L2, которые запускают синтез белков вирусного капсида [9]. Ранние гены работают в базальных клетках эпителия. В дифференцированных кератиноцитах активны поздние гены и происходит сборка инфекционных вирусных частиц (рис.4). Но зачастую последний этап отсутствует, и вирус остается в клетке в виде свободной или встроенной в клеточный геном ДНК [5].
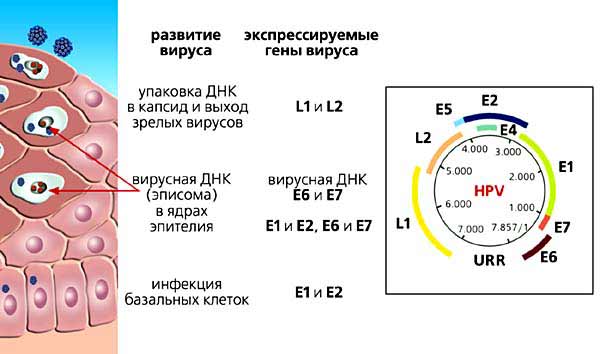
Рис. 4. Этапы развития папилломавирусной инфекции (слева) и структура генома HPV.
Особую роль в иммортализации и трансформации клетки играют вирусные гены Е6 и Е7. Кодируемые ими белки вмешиваются в работу клеточного генома, нарушая регуляцию клеточного цикла. Наиболее важна инактивация клеточных генов p53 и pRb, в норме препятствующих раковому перерождению клетки и называемых поэтому онкосупрессорами (подавляющий опухоль). Работа генов-онкосупрессоров обеспечивает нормальное чередование фаз роста и деления клетки. Нарушение их функций отмечается во многих опухолях различного типа, не только вызванных вирусом. Воздействует вирус и на работу других генов клетки, контролирующих ее нормальное деление. Один из механизмов воздействия - избирательная модификация (метилирование) тех участков клеточной ДНК, которые регулируют работу генов. У неонкогенных типов папилломавирусов гены Е6 и Е7 также способны инактивировать онкосупрессоры р52 и pRb, но менее эффективно. Еще один вирусный ген, участвующий в трансформации клетки, - ген E5 - у части вирусов группы низкого риска неактивен или вообще отсутствует.
При изучении вирусного канцерогенеза выяснилась роль ряда клеточных генов, поддерживающих нормальные функции клетки. Это позволило установить последовательность событий, приводящих к их нарушению и переходу от запрограммированной смерти клетки (апоптоза) к неограниченному росту и делению. Показано, что индивидуальные генетические характеристики влияют на способность организма сопротивляться инфекции и защищать геном клетки от вирусной атаки.
Индивидуальной особенностью, влияющей на итог столкновения с вирусом, могут служить изменения гена p53. Некоторые его варианты кодируют белок, более устойчивый к инактивации при папилломавирусной инфекции. Эта устойчивость зависит от того, какая аминокислота находится в позиции 72 данного белка (пролин - устойчивый вариант, аргинин - восприимчивый). Предположили, что различия по частоте встречаемости устойчивого варианта p53 в разных этнических группах могут объяснить разный уровень заболеваемости раком шейки матки в них, но эти предположения нельзя считать доказанными [10, 11]. Исследуется влияние на развитие папилломавирусной инфекции и вариаций по другим генам человека.
Лечение и профилактика рака
С помощью современных молекулярно-генетических методов удалось не только понять фундаментальные закономерности жизнедеятельности нормальной и раковой клеток, но и найти новые способы диагностики и лечения. Например, изменения клеток эпителия шейки матки можно обнаружить при гинекологическом осмотре и цитологическом анализе мазков. Однако эти методы не позволяют предсказать направление дальнейших изменений и возможности злокачественного перерождения. Выявление вирусной ДНК и определение того, к какой группе (высокого или низкого риска) этот вирус относится, дают возможность достаточно точного прогноза. При этом диагноз может быть поставлен на ранних этапах развития опухоли. А от правильного диагноза и раннего начала лечения зависит успех в борьбе с этим недугом. Конечно, дополнительный анализ для определения типа вируса делает обследование несколько дороже, но даже дорогие средства ранней диагностики намного дешевле, чем дорогие и менее эффективные средства лечения запущенных стадий болезни.
Основная доля заболеваемости раком шейки матки приходится на бедные страны. В развитых странах систематические гинекологические осмотры и цитологические анализы мазков привели к тому, что поздние стадии рака шейки матки там практически отсутствуют. К сожалению, России до этого еще далеко и из-за отсутствия постоянного контроля здоровья женщин, и из-за недоступности многих методов. Поэтому до 40% случаев рака шейки матки, выявляемых у российских женщин, - это запущенные поздние стадии, с трудом поддающиеся лечению.
Тем не менее создание вакцины актуально для всех. Ее разработка стала возможна тогда, когда была окончательно доказана роль вирусной инфекции в развитии рака шейки матки и определены молекулярно-генетические механизмы этого процесса. В основу вакцины положен синтез белков вирусного капсида, способных к самосборке и образованию вирусоподобных частиц (рис.5). Эти частицы идентичны по своим иммунологическим свойствам нативному вирусу, но не содержат ДНК, поэтому и не вызывают заболевания. При вакцинации вырабатываются антитела, способные нейтрализовать вирус и препятствовать распространению инфекции. Оказалось, что содержание этих антител сохранялось на достаточно высоком уровне в течение пяти лет наблюдений.

Рис. 5. Электронные микрофотографии частиц папилломавируса, используемые для вакцинации.
Видны полные (с ДНК) и пустые капсиды. Справа - вирусоподобные частицы HPV, состоящие из белка L1.Среди более чем тысячи вакцинированных молодых женщин (без признаков папилломавирусной инфекции) через полтора года ни одна ее не имела, тогда как в аналогичной группе без вакцинации у 40 женщин инфекция была выявлена. Испытания на животных моделях и на тысячах добровольцев показали почти 100%-ю эффективность вакцины: у вакцинированных женщин не возникает папилломавирусная инфекция и не развивается рак шейки матки. Побочные эффекты за более чем пять лет испытаний не выявлены.
Летом 2006 г. после многочисленных клинических испытаний коммерческий препарат гардасил, производимый фирмой “Merck”, выпущен на мировой рынок. Аналогичный препарат церварикс, разработанный “GlaxoSmithKline”, появится в конце 2006 г. В некоторых странах (США и странах Евросоюза) уже принято решение об обязательной вакцинации девочек, при этом рекомендуется проводить ее в возрасте от 9 до 12 лет. Эта вакцина может быть также высокоэффективной для молодых женщин, не инфицированных HPV. Эффективность вакцинации может быть существенно ниже для инфицированных женщин и еще ниже для женщин с интраэпителиальными дисплазиями. Использовать вакцину для женщин с уже возникшим раком шейки матки вряд ли имеет смысл.
Таким образом, создание вакцины против рака шейки матки - это реальный факт, который, несомненно, относится к числу наиболее значимых за последнее десятилетие достижений в общественном здравоохранении. Хотелось бы подчеркнуть, что создание такой вакцины было бы невозможно без огромного вклада фундаментальной науки - без понимания вирусной природы заболевания, без знания точной структуры ДНК и белков вируса, молекулярных механизмов индуцируемого им опухолевого процесса.
Пока это только первый пример успешной противоопухолевой вакцинации. Конечно же, за последние годы достигнуты огромные успехи в химиотерапии опухолей и лейкозов, и можно с уверенностью предполагать, что количество новых эффективных препаратов против опухолей будет возрастать. Но это лечение, а предотвращение заболевания всегда более эффективно, чем его лечение. В России регистрируется более 12 тыс. случаев рака шейки матки в год, и 7700 женщин ежегодно (т.е. 21 женщина ежедневно) умирают от этой болезни. В случае введения вакцины можно ожидать, что рак шейки матки исчезнет из эпидемиологических сводок. Мы обязаны думать о будущих поколениях, и вакцинация против опухолей шейки матки должна быть очень важным компонентом национальных программ по здравоохранению.
Литература
1. Прохоров Б.Б. // Человек. 2002. №2. С.54-65.
2. Ferlay J., Bray F., Pisani P., Parkin D.M. GLOBOCAN 2002: cancer incidence. Mortality and prevalence worldwide. IARC cancer base no. 5, version 2.0. Lyon, 2004.
3. Diamandopoulus G.T. // Anticancer. Res. 1996. V.16. P.1595-1602.
4. DiMaio В., Liao J.B. // Advances in Virus Research. 2006. V.66. P.125-159.
5. Киселев Ф.Л. // Биохимия. 2000. Т.65. С.79-91.
6. Bosch F.X, Lorincz A., Munoz N., Meijer C.J., Shah K.V. // J. Clin. Pathol. 2002. V.55. №4. P.244-265.
7. Trottier H., Franco L. // Vaccine. 2006. V.24S1. P.4-15.
8. Goodman A., Wilbur D.C. // N. Engl. J. Med. 2003. V.349. №16. P.1555-1564.
9. Zheng Z.M., Baker C.C. // Front Biosci. 2006. V.11. P.2286-2302.
10. Storey A., Thomas M., Kalita A. et al. // Nature. 1998. V.393. P.229-234.
11. Arbel-Alon S., Menczer J., Feldman N., Glezerman M., Yeremin L., Friedman E. // Int. J. Gynecol. Cancer. 2002. V.12. P.741-744.