№1, 2006 г.
№1, 2006 г.
© Киселев С.Л.
Гены и генная терапия
С.Л. Киселев
Сергей Львович Киселев, д.б.н., проф., зав. лаб. молекулярной генетики рака Ин-та биологии гена РАН.
Несколько лет назад на уровне глав государств, как великое достижение человечества, было всемирно заявлено о прочтении первичной последовательности генома человека, включающей предположительно порядка 30-40 тыс. генов. Что же такое ген, для чего он нужен в организме и почему его можно использовать как терапевтическое средство?
Существование единицы наследственности, т.е. некой условной единицы, которая определяет передачу того или иного признака от родителей к детям, предсказал еще в позапрошлом веке Грегор Мендель. Скрупулезно наблюдая за горохом в ряду поколений, он вывел свои знаменитые законы. В первой половине прошлого, XX в., эти законы развил Томас Морган. Для целого поколения российских ученых менделизм-морганизм означал клеймо, за которое либо ссылали, либо просто заставляли отречься от своих убеждений. Ко второй половине XX в. стало более или менее понятно, что представляет собой единица наследственной информации. Ее материальный носитель, ДНК (дезоксирибонуклеиновая кислота), находящаяся в ядре клетки, служит некой матрицей, позволяющей благодаря заложенной в ней программе существовать всему живому, от вирусов до человека. Эта возможность реализуется через два универсальных механизма, заложенных в структуре и коде ДНК: репликации и транскрипции. Репликация - процесс воспроизводства: цепи двуцепочечной молекулы комплементарны, благодаря чему она сама достраивает себя и таким образом обеспечивается идентичность. В ходе транскрипции с одной цепи синтезируется рибонуклеиновая кислота (РНК), с которой уже считываются функциональные белки, из которых построено все живое.
Зачем такой сложный механизм? Поскольку уникальная последовательность всех нуклеотидов - кирпичиков ДНК - невероятно большая (несколько миллиардов нуклеотидов), копирование такого количества невозможно без неких ошибок. Одни устраняются в ходе синтеза ДНК (репарация), другие на этапе синтеза РНК, третьи при синтезе белков. Однако система не совершенна, и случаются ошибки, которые дают начало мутациям. Одни из них - вредные, могут приводить к преждевременной гибели организма, другие - положительные, дают ему некие преимущества, а третьи - безразличны в пределах некого периода времени.
Известно, что почти все заболевания так или иначе связаны с нарушением работы генов, т.е. с негативными мутациями. И генная терапия как один из подходов молекулярной медицины направлена на то, чтобы так или иначе восстановить контроль за работой и функцией гена. В одних случаях, когда больные клетки потеряли функцию какого-либо гена, ее необходимо восстановить. Осуществляется это путем физического переноса гена в организм и далее в клетку. В других случаях, когда болезнь вызывается избыточной функцией, не свойственной нормальной клетке (например, при раке или инфекционных заболеваниях), работу гена надо подавить.
Принципиальное отличие генной терапии от любой другой в том, что она направлена на устранение не симптомов заболевания, а его первопричины. В недалеком будущем благодаря созданию генетической карты каждого отдельного человека можно будет предсказать, а, значит, и предотвратить вероятную предрасположенность к заболеваниям. Некоторые из них уже сегодня могут служить объектом генной терапии (табл.1).
Составляющие генной терапии
Прошло 15 лет с того момента, когда начались испытания генного воздействия на детей с дефектом гена фермента аденозиндезаминазы (ADA). В организм вводили аденовирус, который кодировал недостающий фермент. Вирус проникал в клетки, и тогда генетически модифицированные клетки синтезировали аденозиндезаминазу. Такая терапия позволила почти втрое сократить лекарственное лечение, стоимость которого составляла 60 тыс. долл. в год.
В настоящее время в мире проводится множество клинических испытаний по генной терапии тех или иных заболеваний (рис.1). За прошедшие годы генная терапия испытала целый ряд подъемов и падений, которые были вызваны широко разрекламированными, но не оправдавшимися ожиданиями. Это связано в первую очередь с тем, что коммерциализация и применение технологий стали опережать процесс познания законов природы. Развитие генной терапии можно сравнить с эволюцией биотехнологии, которая в начале 80-х находилась в глубочайшем кризисе, а теперь занимает ведущее положение наравне с информатикой.
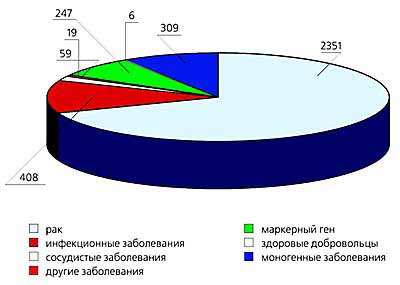
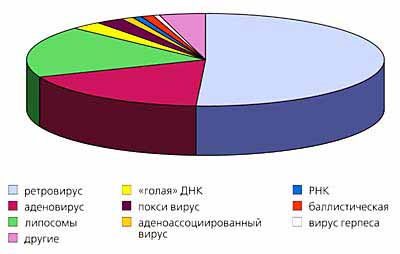
Рис.1. Диаграммы количественного распределения пациентов по типам заболеваний (вверху) и по типу использования векторов.Сегодня существует два типа генно-терапевтического воздействия: ex vivo и in vivo, но в любом случае это воздействие оказывается на соматические клетки, а не на клетки зародышевого пути. В случае eх vivo подход индивидуализирован: генно-инженерные манипуляции сначала проводят с клетками пациента in vitro, потом уже эти генетически обработанные клетки попадают обратно в организм. В случае in vivo ген вводят в организм пациента в составе векторной молекулы.
До настоящего времени все клинические исследования сфокусированы на внесении дополнительных генов, а не на коррекции существующих или на их замещении, что значительно сложнее. Но в любом случае ген необходимо доставить во все, в любые или в какие-либо определенные типы клеток и тканей. Отсюда следует два важных вывода. Во-первых, неотъемлемость генной терапии от Т-клеток и, как следствие, отсутствие генной терапии как таковой, а реальное существование генно-клеточной терапии. Оба эти термина мы в дальнейшем будем отождествлять. Во-вторых, как и для любого вида лекарственной терапии, основной проблемой остается доставка действующего начала (в нашем случае гена) в нужное место и с высокой эффективностью. Транспорт и проявление нужного гена в клетке обеспечивает вектор, к которому “прикрепляются” гены или их фрагменты. Вектор - широкое понятие: это общее название “транспортного средства” для целенаправленной доставки того или иного вещества, и не только гена, а любых, даже таких традиционных лекарств, как анальгина или аспирина. Лекарственный препарат, попадающий в организм, как правило, традиционным путем, действует почти на все клетки, а надо подействовать или на определенную группу клеток, или даже на участок генома, специфичный для определенной группы клеток. С другой стороны, транспортируемое вещество необходимо “защитить” от повреждений. Сегодня самая большая проблема медицины, которую пытаются решить десятки биотехнологических компаний, - направленная, т.е. векторная доставка и ее эффективность.
Для генной терапии векторы бывают либо синтетическими (основаны на полимерных материалах, например липосомах), либо “натуральными”, т.е. природного происхождения (чаще всего это вирусы или плазмиды). Вирусы, применяемые здесь в качестве векторов, лишены своих вредоносных свойств и практически безопасны для человека. Но, к сожалению, реально возможна недоработка в технологии. Тому есть примеры, ставшие одной из основных причин временного спада интереса к этому направлению медицины. Так, в конце 90-х была зафиксирована смерть от генной терапии, когда вектором служил аденовирус. На самом деле смерть вызвал не вектор, а превышение дозы, определенной протоколом исследования, а также недоработка технологии, в результате чего произошла интоксикация организма пациента из-за его повышенной чувствительности. Но здесь скорее виноват человеческий фактор, потому что индивидуальные реакции организма часто непредсказуемы. Известно, что в мире от предоперационного наркоза ежегодно гибнут или остаются полными инвалидами примерно 40 тыс. человек. И с этим пока ничего сделать нельзя.
В 2002 г. проявились осложнения в ходе другого клинического исследования. Речь идет о так называемой ОКИН (острой комбинированной иммунной недостаточности) - тяжелой врожденной патологии, при которой новорожденного ребенка немедленно помещают в специальную стерильную камеру, поскольку любой микроорганизм для него смертельно опасен. Такие дети редко доживают до своего первого дня рождения, а стоимость поддержания их жизни очень высока. Во Франции проводятся клинические испытания метода генной терапии при лечении ОКИН. После коррекции гена удавалось практически полностью восстановить иммунную систему. Но сначала у одного ребенка, а потом еще у одного началась лейкемия. Это случилось из-за того, что ретровирус, примененный в качестве вектора, встроился в определенное место клеточного генома и нарушил работу других генов. Исследования хотели прекратить, но по требованию родителей их продолжили. Почему? Ответ простой: для таких больных нет других методов лечения. Даже в барокамере их продолжительность жизни - несколько лет. Подобная терапия дает им возможность жить намного дольше и полноценно, а лейкемия, особенно в детском возрасте, хорошо поддается химиотерапевтическому лечению. Грубо говоря, из двух зол выбирают наименьшее. Кроме этого, необходимо помнить слова Парацельса: “Яд - это всего лишь вопрос дозы”. Завышенная доза ретровирусного вектора нарушает работу других генов. А подбор эффективной терапевтической дозы, не имеющей негативных последствий, и есть одна из важнейших задач как доклинического исследования, так и клинических испытаний.
Другие векторные молекулы проникают в клетки организма с меньшей эффективностью, но одновременно и более безопасны. Совсем недавно в сотрудничестве с Научно-исследовательским центром сердечно-сосудистой хирургии им.Бакулева нашей лабораторией была продемонстрирована эффективность использования нативной, или так называемой “голой” плазмидной ДНК, кодирующей стимулятор роста сосудов - васкулярный фактор роста эндотелия (VEGF). Испытания проводились на пациентах с периферической ишемией, у которых нарушено кровоснабжение тканей. Если стимулировать рост сосудов, ишемия отступит, восстановится нормальная ткань и кровоснабжение. Полученные результаты оказались замечательными: у всех пациентов, включая тех, кому грозила ампутация, наблюдался долговременный и сильный эффект. Применение подобной терапии у пациентов с ишемией сердца на настоящий момент подтверждает эффективность метода.
Терапия опухолей
Не секрет, что, несмотря на существенное улучшение методов борьбы с опухолями, онкологические заболевания продолжают оставаться одной из основных причин смертности. По данным Национального ракового института США, за последнее десятилетие смертность от рака снизилась на 15-17%, но одновременно с этим встречаемость заболевания увеличилась на 50%. Похоже, что эффективность традиционных методов лечения рака достигла своего максимума. Необходимо искать принципиально новые подходы к терапии опухолей. Достижения современной молекулярной биологии и генетики позволяют надеяться, что такие средства будут найдены.
В настоящее время молекулярно-генетические принципы возникновения опухолей в основном понятны. Открыта и охарактеризована большая группа онкогенов, мутации в которых приводят к их повышенной экспрессии и, как следствие, к злокачественной трансформации клеток. Другая группа генов, обозначаемых как гены-супрессоры опухолей, кодируют белки, подавляющие клеточный рост. Инактивация таких генов также способствует превращению нормальной клетки в опухолевую. Наконец, выявлено большое число генов, изменения в которых всегда ведут к перерождению первичной, относительно доброкачественной опухоли. Ее клетки становятся злокачественными, способными к инвазивному, деструктивному росту и метастазированию, т.е. переносу и росту в новых местах. Более того, трансформированные клетки могут атаковать и уничтожать нормальные клетки организма.
Хотя мы узнали очень много о механизмах возникновения рака, это не привело к немедленному решению проблемы рака, т.е. к разработке методов его лечения. Одна из причин - разнообразие генетических изменений, вызывающих рак. Более того, в одной опухоли могут присутствовать клетки с разными генетическими портретами, которые выражаются в виде опухолевых антигенов. Другая причина - невозможность вызвать генетические изменения абсолютно во всех опухолевых клетках так, чтобы подавить их рост. Наконец, третья причина - это высокая пластичность опухолевых клеток, их способность накапливать мутации, сохраняя жизнеспособность. В результате некоторым клеткам удается избежать гибели, и они снова дают рост опухоли.
Таким образом, современные подходы к генной терапии опухолей основаны, во-первых, на нормализации работы мутировавшего гена (онкогена или гена-супрессора) и, во-вторых, на обучении иммунной системы организма распознавать опухолевые антигены и активировать противоопухолевый иммунный ответ.
К первому относятся попытки подавить работу наиболее часто активируемых онкогенов, например, онкогена ras, или, наоборот, вызвать образование нормального продукта гена-супрессора опухолей, например, белка р53. В частности, заражение опухолей вирусами, синтезирующими нормальный белок р53, останавливает развитие опухоли, хотя и не приводит к полному излечению.
Здесь мы подходим к основополагающей проблеме любой неинвазивной терапии. Ведь если мы инфицируем вирусным вектором целый организм, то и нормальные клетки заражаются вирусом, который будет всегда либо синтезировать нормальный белок р53, либо инактивировать экспрессию гена ras. И то и другое может иметь негативные последствия для нормальной клетки. Значит, повысить эффективность воздействия и снизить негативные эффекты может только направленная или адресная доставка терапевтического средства. Работы в данном направлении интенсивно ведутся, но каких-либо существенных достижений пока не опубликовано.
Второй подход основан на мобилизации иммунной системы организма против опухоли. В рамках теории иммунного надзора, трансформированные клетки должны удаляться с помощью клеток иммунной системы. Однако наличие опухолей указывает на низкую эффективность этого надзора, а может быть, и на его полное отсутствие. Одновременно с этим имеется целый ряд документированных фактов, подтверждающих принципиальную возможность существования противоопухолевого иммунитета. Это и случаи спонтанной регрессии опухоли; и обнаружение в организме пациентов клеток иммунной системы, распознающих опухолевые клетки; и многочисленные эксперименты на животных, в которых достигался терапевтический эффект. Эти факты не могли не привести к идее противоопухолевой вакцинации, тем более что противопатогенные вакцины уже доказали свою эффективность. Но в данном случае речь идет не о профилактической вакцинации, а о вакцинации уже инфицированного организма, т.е. о терапевтической вакцинации, что весьма непросто, если нужно вызвать специфический иммунный ответ. “Иммунизировать против рака будет так же сложно, как организму отторгнуть правое ухо, оставив незатронутым левое”, - писал В.Вуглум в журнале “Раковые исследования” (США) в начале XX в.
За последнее десятилетие за рубежом проведено большое количество клинических испытаний по противоопухолевой вакцинации. Так, в США за один только год (2003) прошло более 100 клинических исследований по вакцинотерапии опухолей. В основном их можно разделить на три группы. К первой относят клинические исследования, в которых в качестве иммуногенов используются известные опухолевые антигены в виде синтетических пептидов. Для этого определяется наличие этих антигенов в опухоли пациента и проводится иммунизация соответствующими пептидами. При подобном подходе частичный регресс опухоли достигался только в 2-3% случаев. С точки зрения клинической медицины применение стандартизованных химических пептидов имеет неоспоримое преимущество. Однако, во-первых, эффективность такой вакцинации незначительна, во-вторых, количество известных опухолевых антигенов еще очень ограничено. Кроме того, в организме пациентов уже сформировалась толерантность к опухолевым антигенам, используемым для вакцинации. Значит, необходимо каким-то образом либо преодолеть эту толерантность, либо применять те опухолевые антигены, на которые она еще не сформировалась.
Эти задачи пытаются решить в исследованиях, относящихся ко второй группе. Здесь источником опухолевых антигенов служат сами инактивированные опухолевые клетки, которые для преодоления толерантности генетически модифицируются, чтобы секретировать различные цитокины, такие как интерлейкин-2, -4, -7, интерферон, фактор, стимулирующий рост колоний, и целый ряд других. Все перечисленные цитокины принимают участие в формировании приобретенного иммунного ответа. Большинство опухолевых клеток, модифицированных для продукции определенных цитокинов, in vitro не замедляют свой рост. Однако in vivo рост опухоли значительно замедляется, что говорит об активации иммунного ответа организма благодаря цитокинам. Механизмы данного процесса до конца не ясны и могут отличаться для различных цитокинов. Тем не менее использование инактивированных цитокин-продуцирующих опухолевых клеток для иммунизации пациентов применяется в клинике, однако его эффективность составляет 3-4%.
К третьей группе относятся вакцины на основе дендритных клеток пациента, которые нагружаются вне организма (ex vivo) опухолевыми антигенами в виде пептидов или клеточных лизатов. Эффективность такой вакцинации, а именно случаи частичного регресса опухоли, составляет 7-7.5%.
Как видно из приведенных клинических данных, эффективность терапевтических вакцин достаточно низкая. Как это объяснить и как повысить их эффективность?
Для того чтобы разобраться со сложным процессом возможного противоопухолевого ответа, совершим небольшой экскурс в теорию иммунного ответа. В упрощенном виде иммунная система атакует то, что имеет признак “чужого” или/и не имеет признака “своего”. Эволюционируя, иммунная система должна была противостоять, в первую очередь, наружной инфекции, которая не имеет признаков “своего”, но несет признак “чужого”. Но трансформация собственных клеток организма и, как следствие, отсутствие признака “чужой”, а в то же время присутствие признака “свой”, приводит к возникновению толерантности в отношении переродившихся клеток. В данном случае мы даже не рассматриваем те опухоли, которые сами “научились” распознавать и атаковать клетки иммунной системы, например, через Fas лигандзависимый лизис. Таким образом, чтобы обеспечить эффективное распознавание опухолевых клеток, мы должны пометить их маркером “чужой”, а чтобы удалить их - активировать цитотоксический ответ.
Антиген-презентирующие клетки (АПК), к которым относятся дендритные клетки, макрофаги и некоторые другие, взаимодействуют с патогеном. Поглощенный патоген индуцирует синтез антигенных пептидов, которые представляются в комплексе с антигенами главного комплекса гистосовместимости (major histocomplatibility complex - MHC), формируя первый сигнальный каскад. Одновременно с этим АПК распознает “чужого”, запускает цитокиновый каскад и синтезирует костимуляторную (кооперативно действующую) молекулу В7, обеспечивая второй сигнальный каскад. Таким образом наивная Т-клетка превращается в обученную клетку-помощника. Через сложный каскад цитокинов и взаимодействий такая клетка инициирует антительный и/или цитотоксический Т-лимфоцитарный ответ (рис.2). Для надежности природой придуманы два сигнала, помогающие избежать ответа на “свои” антигены, который может привести к аутоиммунным заболеваниям. В случае злокачественной трансформации клеток организма именно отсутствие второго сигнала блокирует противоопухолевый ответ иммунной системы. Распознавание “чужого” происходит с помощью врожденной системы защиты организма.
Рис.2. Схема взаимодействия антиген-презентирующей клетки (АПК) с Т-лимфоцитом, который еще никогда не встречался с патогенами. Для того, чтобы Т-лимфоциты научились распознавать патоген, необходимо образование Т-хелперов - лимфоцитов-помощников (Тh1, Th2). Это происходит лишь в случае получения двух сигналов: одного - через Т-клеточный рецептор (TCR) от главного комплекса гистосовместимости второго типа (МНСII), второго - благодаря взаимодействию костимуляторных молекул CD28 и В7. Первый сигнал обусловливает последующую направленность Т-лимфоцита на определенный антиген, а второй подтверждает чужеродность антигена. Т-лимфоциты узнают этот антиген на поверхности любой другой клетки организма, которую нужно уничтожить. Антиген-презентирующая клетка обеспечивает Т-лимфоцит обоими сигналами. Для синтеза В7 АПК должна посредством патоген-распознающих молекул узнать “чужое”. Одновременно с этим патоген поглощается антиген-презентирующей клеткой, а его антигенные пептиды транспортируются на поверхность АПК с молекулой MHCII. Весь этот контактный процесс дополнительно сопровождается секрецией определенных цитокинов.Еще не так давно врожденная система защиты рассматривалась как некая примитивная система, обеспечивающая первичную защиту организма от инфекций. Теперь стало ясно, что она не столь примитивна, а должна сложным образом отличить “свое” от “чужого” и, более того, без ее правильного функционирования нет адекватного адаптивного ответа организма. В систему врожденного распознавания “чужого” и адекватного реагирования вовлечен целый ряд распознающих и сигнальных молекул. Наиболее хорошо изучено семейство TLR (Toll like receptors) млекопитающих.Совсем недавно в нашей лаборатории, а позднее и зарубежными исследователями обнаружено новое семейство сигнальных и распознающих молекул. Мы назвали новое семейство Tag7 - по первому обнаруженному члену семейства, а зарубежные авторы - PGRP; они работали на стандартном объекте генетиков - плодовой мушке дрозофиле, а мы изучали функции представителей этого семейства у млекопитающих. Перечислять все выявленные функции этих молекул в рамках одной статьи не имеет смысла. Остановимся на найденных и оказавшихся существенными для дальнейшей работы по созданию противоопухолевой вакцины. Первое замечательное свойство секретируемого белка Tag7/PGRP состоит в том, что он привлекает к месту секреции (т.е. к клеткам, выделяющим белок в окружающую среду) клетки иммунной системы, в том числе и профессиональные антиген-презентирующие клетки. Второе его свойство, которое решили использовать при создании вакцины, - способность активировать созревание дендритных клеток, т.е. стимулировать экспрессию сигнальной молекулы В7, которая и обеспечивает последующее созревание наивного Т-лимфоцита.
Насколько эффективен тот или иной подход, какой механизм вовлечен в формирование противоопухолевого ответа, изучается на экспериментальных моделях, на животных. Мы использовали линии клеток мышиной меланомы, которые могут расти как в культуре (вне организма), так и после их введения животным. В культуре клетки наращивались до определенного количества, затем их генетически модифицировали вектором, содержащим ген tag7/PGRP. После этого опухолевые клетки начинали секретировать белок Tag7/PGRP, количество которого измерялось. Далее клетки облучали для подавления их деления, т.е. инактивировали, и вводили животным в качестве вакцины. Через 10 дней, после формирования иммунного ответа, в противоположную ногу животным вводили исходные (неинактивированные и немодифицированные) опухолевые клетки и в дальнейшем наблюдали за ними. Оказалось, что на иммунизированных таким образом животных опухоли практически не формировались или, появившись, вскоре исчезали, все животные при этом выживали. В контрольных группах животных опухоли развивались, и мыши погибали.
В других экспериментах мы использовали так называемых “голых” мышей - у них отсутствуют Т-лимфоциты. Считается, что именно эти клетки играют одну из основных ролей в элиминации опухолей. Животным, полностью лишенным Т-клеток, вакцинация не помогала, что говорило о том, что и в нашем случае Т-клетки чрезвычайно важны для противоопухолевого ответа. Последующие опыты показали, что в наблюдаемом нами противоопухолевом ответе организма определенное участие принимают и натуральные киллеры, и В-лимфоциты. Никаких побочных негативных явлений, вызванных вакцинацией, не отмечалось. Более трех лет в нашей лаборатории шли опыты на животных, а результаты публиковались в престижных международных журналах. В терапевтической схеме, т.е. когда сначала вводили опухолевые клетки и лишь потом вакцину, эффективность была меньше, но тем не менее большое количество животных выживало.
После успешных экспериментов на животных в 2000 г. решили начать клинические испытания. В этом нам очень помогли руководство и сотрудники РОНЦ им.Н.Н.Блохина РАМН в Москве и НИИ онкологии им.Н.Н.Петрова в Санкт-Петербурге. Составили Протокол проведения клинических испытаний. По действующим жестким правилам первые испытания новых способов лечения проводятся на пациентах, которым уже никакая другая терапия помочь не в состоянии; в данном случае на больных меланомой (одним из самых страшных видов рака), для которых методы лечения были исчерпаны.
Схема индивидуального приготовления вакцины выглядит следующим образом: из удаленной во время хирургической операции опухоли отбирается первичный опухолевый материал, и из него в лабораторных условиях получают первичную опухолевую клеточную линию. Далее эти клетки размножают и подбирают условия для их генетической модификации. После проведения самой генетической модификации, инактивации опухолевых клеток радиацией и определения уровня экспрессии гена вакцина готова. В 2001 г. вакцинировали первого пациента. К настоящему времени начальную фазу испытаний можно считать успешно завершенной. По результатам проведенных исследований написана и опубликована статья в международном журнале.
Каков краткий итог проведенных исследований? Нашим коллегам-клиницистам удалось добиться стабилизации заболевания в 25% случаев, а частичного регресса опухоли - в 7% случаев. Конечно, эти цифры не впечатляют, но если сравнить с выше приведенными данными, где эффективность похожего подхода составляла всего 3%, то использование активаторов врожденного компонента иммунной защиты (белка Tag7/PGRP) повысило положительную динамику в два раза. В то же время надо понимать, что с помощью вакцины практически нельзя удалить большую опухоль, тем более если пациент уже прошел курс химиотерапии и его иммунная система подавлена не только прогрессирующей опухолью, но и проводимой терапией. Какова же область применения аутологичной вакцины? Несомненно, она нужна после хирургического вмешательства, чтобы избежать рецидивов заболевания. Когда удален крупный опухолевый узел, возможный источник метастазов, эта вакцина способна уничтожить невидимые глазу врача единичные опухолевые клетки.
Зарубежные лаборатории и клиники уже накопили большой опыт подобных работ. В России же - это первое и пока единственное клиническое испытание вакцинотерапии опухолей с помощью аутологичных генетически модифицированных клеток. За это время нам пришлось преодолеть массу трудностей. Эффективность получения клеточной линии из опухолевого материала весьма низкая, порядка 10-15%. Реально приготовление вакцины занимает 3-5 мес и требует участия квалифицированных специалистов, которых в нашей стране практически не осталось. Кроме этого, для работы необходимы высококачественные импортные клеточные реагенты, специальное оборудование, абсолютная стерильность, а это существенно влияет на стоимость исследований. Клиническое исследование, проведенное нами, оказалось возможным только благодаря поддержке, получаемой от мэра г.Москвы Ю.М.Лужкова.
Несомненно, предложенный нами подход показал свою эффективность, но его можно и нужно улучшать. Во-первых, необходимо в будущей вакцине совместить активацию врожденного компонента и приобретенного иммунитета. В настоящее время в нашей лаборатории такие исследования проводятся. Во-вторых, сделать клиническое применение вакцины более удобным и менее дорогостоящим. Для этого имеются все предпосылки, поскольку в ходе клинических исследований сформировался банк опухолевых клеточных линий, охарактеризованных по многим параметрам. В настоящее время мы подбираем наиболее эффективные с точки зрения представленности опухолевых антигенов клеточные линии для приготовления аллогенной (не персональной) генетически модифицированной вакцины. Такой стандартный препарат, готовый к использованию, сократит и время от момента операции до начала его применения.
В заключение хочется подчеркнуть два важных момента. Для лечения онкологических заболеваний нельзя найти одно универсальное лекарство - слишком многообразны трансформированные (злокачественные) клетки. Именно поэтому мы разработали целый ряд генно-терапевтических подходов по блокированию кровеснабжения опухоли. Лишенная питания и кислорода опухолевая ткань должна погибнуть. Но даже и комбинация двух методов не станет панацеей. Необходимы дальнейшие исследования и испытания методов. При этом всегда надо помнить, что чудес не бывает.